
- •Комплексті қосылыстар ерітіндідегі химиялық тепе-теңдігін өрнектеңіз. Тұрақтылық және тұрақсыздық константалары үшін теңдеулер келтіріп, арасындағы байланысты көрсет.
- •2.Жүйелік және бөлшектік анализ дегеніміз не? Мысал келтір. Катиондардың қышқылды-негіздік жіктелуін көрсетіңіз.
- •5. Аналитикалық химияда комплекстүзу процесінің қолданылуын көрсетіңіз ( ашу, бөліп алу, концентрлеу, бүркемелеу, иондарды анықтау). Мысалдармен жауабыңызды дәлелдеңіз.
- •6.Тотығу-тотықсыздану потенциал шамасына қандай факторлар әсер етеді?
- •7. Тұнбаның ерігіштік көбейтіндісі мен ерігіштігі арасында қандай байланыс бар?
- •8. Тұнбаның ерігіштігіне аттас иондардың қандай әсері бар?
- •8. Реалды және идеалды ерітінділер дегеніміз не? Активтілік, активтілік коэффицент пен ерітіндінің иондық күші қалай есептеледі?
- •10. Тұнбаның ерігіштігіне күшті электролиттің қандай әсері бар?
- •11. Гомогенді жүйелер дегеніміз не? Массалар әрекеттесу заңын тұжырымдаңыз. Гомогенді тепе-теңдік тұрақтыларын (термодинамикалық, концентрациялық шартты) келтіріңіз.
- •12. Титриметриялық ерітіндінің концентрациясын өрнектеу тәсілдері мен өзара байланысын көрсетіңіз.
- •13. Титриметриялық анализдің түрлерін көрсетіңіз. Реакцияларға қойылатын талаптар.
- •14. Бастапқы стандарттар және екінші ретті стандарттарға анықтама беріңіз. Бастапқы стандарттарға қойылатын талаптар. Фиксоналдар дегеніміз не? Мысал келтіріңіз.
- •15. Тура, кері және жанама титрлеу арасындағы айырмашылықты көрсетіңіз.
- •16. Титрлеу кезінде индикатор түсі өзгеруін қалай түсіндіруге болады. Мысал келтіріңіз.
- •17. Комплексонометрлік титрлеудің маңызын түсіндіріп, мысал кетіріңіз.
- •19. Комплексондар дегеніміз не? Метал иондарымен әрекеттескенде комплексондардың ерекшелігін көрсетіңіз.
- •20. Аморфты және ірі кристалды тұнбаларды алу жағдайларын көрстіңіз.
Комплексті қосылыстар ерітіндідегі химиялық тепе-теңдігін өрнектеңіз. Тұрақтылық және тұрақсыздық константалары үшін теңдеулер келтіріп, арасындағы байланысты көрсет.
Комплекстік иондар әлсіз электролит болып табылады және сулы ерітіндіде жарым-жартылай диссоциацияланады:
[Fe(CN)6]4- ↔ Fe2+ + 6CN-
[Ag(NH3)2]+ ↔ [Ag(NH3)]+ + NH3
[Ag(NH3)]+ ↔ Ag+ + NH3
Комплексті иондар диссоциациясы процесінің тепе-теңдігі - қайтымды процестің тепе-теңдік константасы болып табылатын тұрақсыздық константасы мен (Кт-з) сипатталады.
Көп лигандты комплекстік ион диссоциациясының әр сатысы тұрақсыздықтың сатылық константасымен сипатталады. Сапалық анализ реакцияларының шарттарында комплекстүзу процесінің сатылығын кейде ескеру керек. Көп лигандты комплекстердің әрбір түрі түзілуі бірінші орында лиганд концентрациясына тәуелді.
Демек,
[Ag(CN)2]-
↔ [Ag(CN)] + CN-
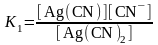
[Ag(CN)] ↔ Ag+
+ CN-

Тұрақсыздықтың жалпы константасы тұрақсыздықтың сатылы константаларының туындысымен анықталады.
Комплексті қосылыстардың тұрақсыздық константасының мәндері кең интервалда өзгереді. Тұрақсыздық константа мәндерінің өте аз мөлшерінде комплекстік қосылыс ерітіндісіндегі металдың бос иондары деген түсінік мағынасын жоғалтады. Екі валентті мыстың иодидті комплексі Кт-з = 1,48.10-30 жағдайында сондай.
[HgI4]2- ↔ Hg2+ + 4I-
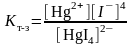
[I-]=1 г-ион/л, [HgI4]2-=1г-ион/л болғанда комплекстің тұрақсыздық константасынан шығатыны – сынаптың бос иондарының концентрациясы 1,48.10-30 г-ион/л тең. Есептеулерден көретініміз 1 литр ерітіндіде осынша сынап иондары болғанда бұл тұздың бір грамм-ионы ерітіндінің 6,75.1029 литрінде болуы керек, ол комплексті қосылыс ерітіндісінде сынап иондарының жоқтығын көрсетеді.
Тұрақсыздықтың сатылы константалары химиялық анализдің түрлі процестерін түсінуде өте маңызды. Жоғарғыдан басқа, барлық комплекстердің концентрациясы өте аз болғанда (өте сирек болады) ғана тұрақсыздық константасы комплекстүзудің көрсеткіші болады. Сондықтан, тәжірибелік есептеулер үшін түзілу константасын немесе комплекстік қосылыстардың () тұрақтылық константасын қолданған ыңғайлы:
Ag+
+ CN-
↔ [AgCN]
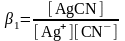
Ag(CN)
+ CN-
↔[Ag(CN)2]-
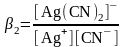
Әдетте сапалық анализде лигандтың артық мөлшері жағдайында қосынды процесстің тұрақтылық константасын бөлек сатылы процесстер константасымен есептеуге болады:
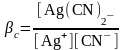 ;
βс
= β1
. β2
;
βс
= β1
. β2
Комплекстік қосылыстың тұрақсыздық константасы және оның тұрақтылық константалары өзара байланысты, сондықтан анықтамалық әдебиеттен біреуінің мәнін білсек, екіншісін анықтауға болады:
 ;
;
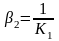 ;
;
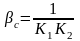 .
.
Аналитикалық химияда иондар құрамы 10-6 г-ион/л аз болғанда комплекс түзеді деп есептеледі.
Комплекстүзілудің сандық көрсеткіштеріне реалды ерітінділерде орын алатын түрлі процестер әсер етеді.
Ерітіндіде
химиялық реакцияға қатыспайтын бөтен
иондар болса, ерітіндінің иондық күшін
ескеру керек және комплекстүзу процесін
тұрақтылықтың термодинамикалық
константаларымен бейнелейді. Есептеулер
жүргізгенде, әсіресе ЭВМ-де, тұрақтылықтың
қосынды константасын (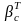 )
қолдану ыңғайлы:
)
қолдану ыңғайлы:
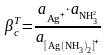 (6)
(6)
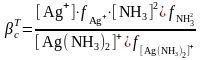
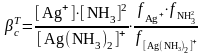
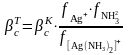 (7)
(7)
Тұрақтылықтың термодинамикалық константалары ерітіндінің аз ғана иондық күшін ескереді және әдетте анықтама кестелерінде беріледі.
Бірақ, тәжірибелік аналитикалық химия үшін комплекстердің тұрақтылықтарының концентрациялық константасын қолдану ыңғайлы, оны ерітінділердің иондық күштерінің мәндері белгілі болғанда термодинамикалық константаларымен есептеп шығаруға болады:
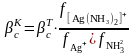 (8)
(8)
Бірқатар жағдайларда [16] анықтамаларда ион күшінің 0-ге 0,1/1 аралығынан тез өңделген тұрақтылық (тұрақсыздық) концентрациялық константа мәндері беріледі, себебі олар термодинамикалық шамалар болып табылады.
Комплекстүзу процесі компоненттерінің бірімен әрекеттесуге қабілетті бөтен иондар (мысалы, сутек иондары, тұндырғыш иондар) ерітіндіде бар болса, онда есептеу және болжау кезінде тұрақтылықтың шартты константасын пайдалану керек.
 ,
(9)
,
(9)
мұнда C[Ag(NH3)2]+, CAg+, CNH3 – комплекстүзу процесіне қатысушылардың жалпы концентрациялары.
Процесс компоненттерінің тепе-теңдік концентрациялары тең:
[Ag+] = CAg+.ἁAg+
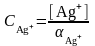 (10)
(10)
[NH3] = CNH3.ἁNH3
 ,
(11)
,
(11)
мұнда αAg+ – күміс ионы қатысында мүмкін жанама реакция коэффициенті, ἁNH3 – NH3 қатысуымен мүмкін жанама реакция коэффициенті.
[Ag(NH3)2]+ комплекстүзу өнімдері үшін жалпы концентрациясы оның тепе-тең концентрациясына тең. Сонда:
Комплекс неғұрлым тұрақты болса, соғұрлым лигандтың жанама протондалу реакциясы әлсіз жүреді. Мысалы:
Ag+ + 2 CN- ↔ [Ag(CN)2]-
