
- •Теплотехника
- •110301 «Механизация сельского хозяйства»,
- •110302 «Электрификация и автоматизация сельского хозяйства»,
- •110303 «Механизация переработки сельскохозяйственной продукции»
- •Введение
- •Основные правила техники безопасности
- •Лабораторная работа № 1 измерение температуры веществ
- •1.1. Цель работы
- •1.2. Задачи работы
- •1.3. Основные понятия
- •1.4. Методы измерения температуры, устройство и принцип работы приборов
- •1.4.1. Термометры расширения.
- •1.4.2. Термометры сопротивления (рис. 1.2 [3]).
- •1.4.3. Термоэлектрические термометры (рис. 1.3).
- •1.4.4. Пирометры излучения.
- •1.5. Проведение работы
- •1.6. Оформление отчета
- •Лабораторная работа № 2 измерение давления и расхода жидкостей и газов
- •2.3.2. Приборы для измерения расхода веществ
- •2.4. Проведение работы
- •2.5. Оформление отчета
- •Лабораторная работа №3 Определение показателя адиабаты воздуха
- •3.4. Описание экспериментальной установки.
- •3.5. Порядок проведения работы.
- •3.6. Обработка полученных данных.
- •3.7. Оформление отчета
- •Лабораторная работа № 4 изучение работы испарительного циркуляционного контура
- •4.4. Описание опытной установки и внутрикотловых процессов.
- •4.6. Проведение работы
- •4.7. Обработка результатов испытаний
- •4.8. Оформление отчёта
- •4.9. Контрольные вопросы
- •Лабораторная работа № 5 Определение коэффициента теплопроводности теплоизоляционных материалов методом трубы
- •5.1 Цель работы
- •5.2 Задачи работы
- •5.3 Теоретические положения.
- •5.4 Описание экспериментальной установки.
- •5.5 Порядок выполнения работы.
- •5.6 Обработка экспериментальных данных.
- •5.7 Оформление отчета.
- •Лабораторная работа № 6 определение коэффициента теплообмена при свободной конвекции воздуха
- •6.3. Описание опытной установки
- •6.4. Проведение испытания
- •6.5. Обработка опытных данных в обычном виде
- •6.6. Обработка опытных данных в критериальном виде.
- •6.8. Оформление отчета
- •Лабораторная работа № 7 изучение холодильной установки и испытание теплообменника – охладителя молока
- •7.4. Описание опытной установки
- •7.5. Проведение испытания
- •7.6. Обработка результатов испытания
- •7.6. Оформление отчета
- •7.7. Контрольные вопросы
- •Приложение 9
- •Содержание
- •Александр николаевич попескул
- •3 Курса очной и заочной форм обучения
Лабораторная работа №3 Определение показателя адиабаты воздуха
3.1. Цель работы.
Закрепление знаний в теории исследования термодинамических процессов, ознакомление с методикой опытного определения показателя адиабаты реальных газов, получение навыков в проведении теплотехнического эксперимента.
3.2. Задачи работы
Экспериментальное определение численного значения показателя адиабаты воздуха и ознакомление с методами обработки результатов эксперимента.
3.3. Теоретические положения.
Адиабатный процесс является одним из наиболее часто встречающихся на практике термодинамическим процессом изменения состояния рабочего тела.
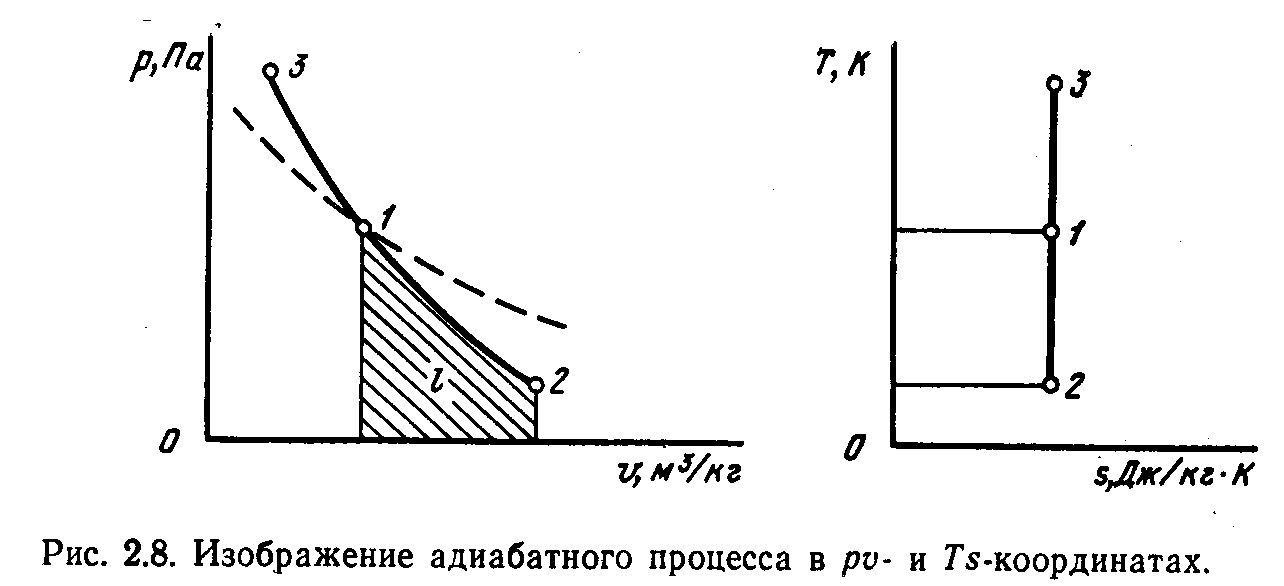
а) б)
Рис. 3.1. Изображение адиабатного процесса в р-v- и Ts- координатах
Адиабатный процесс — это процесс, протекающий без теплообмена с окружающей средой:
Δq=0 (3.1)
Уравнение адиабатного процесса имеет вид [1]:
![]() (3.2)
(3.2)
где k - показатель адиабаты, равный отношению изобарной теплоемкости CP к изохорной CV:
![]() >1 (3.3)
>1 (3.3)
Численное значение показателя адиабаты для идеального газа можно получить исходя из молекулярно-кинетической теории газов:
для одноатомного газа k = 1,66
для двухатомного газа k = 1,4
для многоатомного газа k = 1,33
Для идеальных газов величина k является постоянной, не зависящей от параметров состояния газа.
Связь между изобарной и изохорной теплоемкостями устанавливает уравнение Майера:
СP – СV = R (3.4)
Выразив из (3.4) CP, формулу (3.3) можно привести к виду:
![]() (3.5)
(3.5)
Поскольку для реальных газов теплоемкость СV возрастает с увеличением температуры интенсивнее, чем СР, то значение k с увеличением температуры уменьшается. Величина k для реальных газов одной атомности при прочих равных условиях имеет отличия. Так, например, для двухатомных газов: водород k=1,41; азот k=1,404; воздух k=1,4.
Поскольку k>1, то в р-v-координатах линия адиабаты идет круче изотермы.
Для адиабатного процесса характерны следующие соотношения [1]:
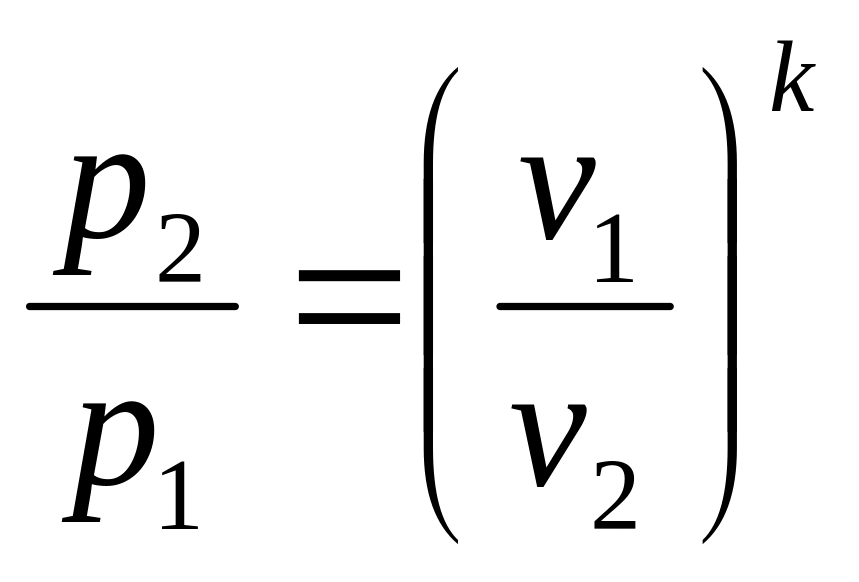
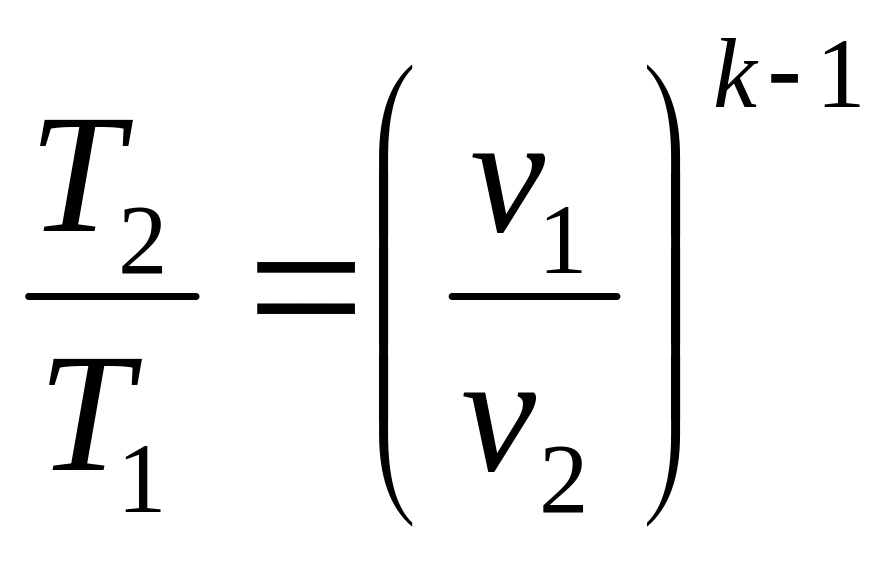
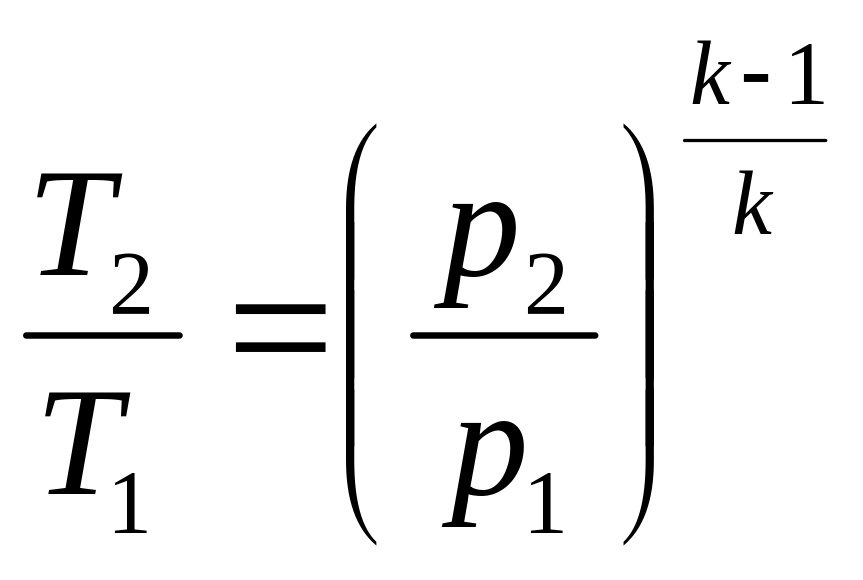 (3.6)
(3.6)
Согласно первому закону термодинамики работа расширения совершается за счет внутренней энергии:
![]() (3.7)
(3.7)
Или ![]() (3.8)
(3.8)
После простых преобразований получаем:
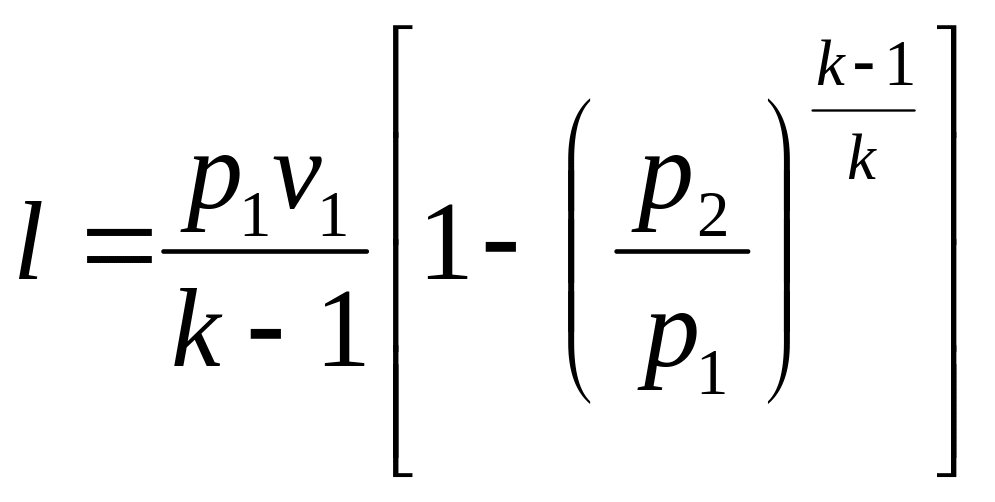 (3.9)
(3.9)
Работа l численно равна площади под кривой 1—2 (рис. 3.1).
Поскольку при адиабатном процессе Δq=0, то ds=0, следовательно, s=const. Адиабатный обратимый процесс является изоэнтропным, т. е. протекает при постоянном значении энтропии. На рис. 3.1 линия 1—2 соответствует расширению рабочего тела (процесс сопровождается уменьшением температуры), а линия 1—3—сжатию рабочего тела.
При адиабатном процессе теплоемкость равна нулю CАД=0.
Допустим, что условия опыта с достаточной степенью точности удовлетворяют уравнению состояния идеального газа:
p·v=M∙R∙T (3.10)
Представим сосуд, заполненный газом, имеющим параметры: давление P1 и температуру Т1, превышающие параметры окружающей среды. За счет охлаждения стенок сосуда окружающей средой и отвода некого количества теплоты q1, температура газа станет равной температуре окружающей среды – Т2, а давление снизится до некого значения Р2 (процесс 1-2 рис.3.2 [6]). Затем быстро выпустим газ из резервуара, соблюдая тем самым условия адиабатного расширения - отсутствие теплообмена с окружающей средой. В конце этого процесса (2-3) давление в сосуде станет равным давлению окружающей среды Р3, а температура понизится до Т3, меньше Т2. Закроем сосуд и выждем некоторое время, в течении которого от окружающей среды к более холодному телу будет подведена теплота q2 (процесс 3-4).
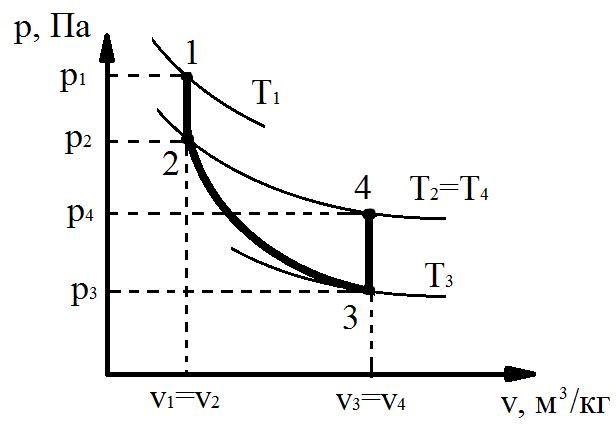
Рис.3.2 К определению показателя адиабаты
В результате температура возрастет до температуры окружающей среды (Т4 =Т2), а давление повысится до некоторого значения Р4.
Учитывая уравнение адиабатного процесса (3.2) можно записать:
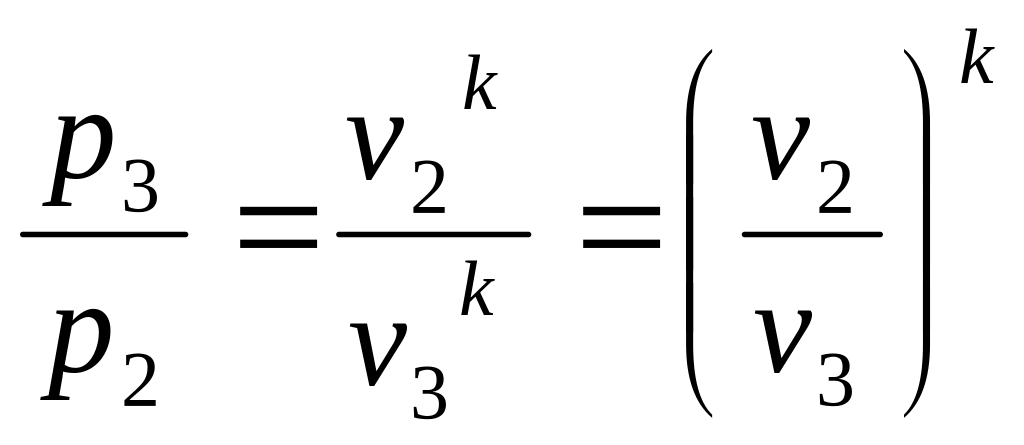 (3.11)
(3.11)
Выведем отсюда k:
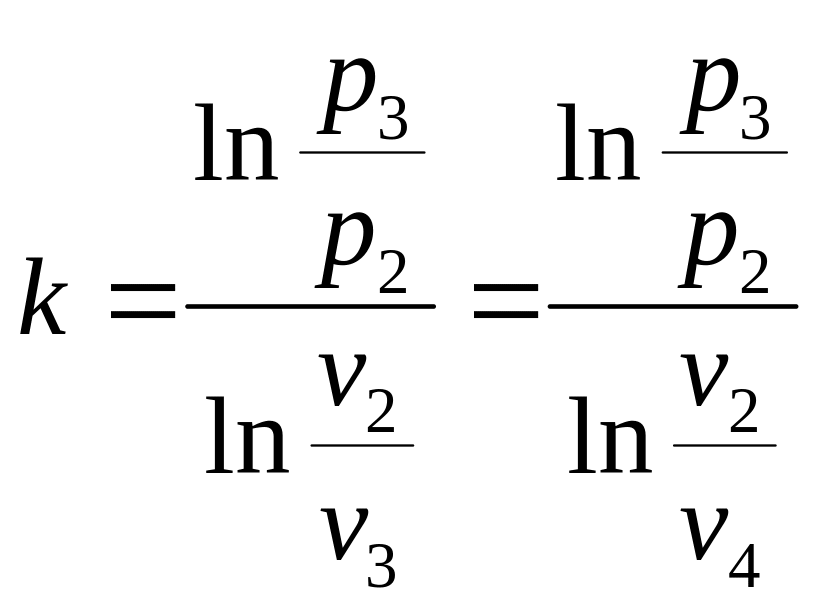 (3.13)
(3.13)
Так как Т2=Т4, можно предположить, что по линии 2-4 протекает условный изотермический процесс (Т=const), которому соответствует выражение:
![]() (3.14)
(3.14)
С учетом выражения 3.14 уравнение 3.13 примет вид:
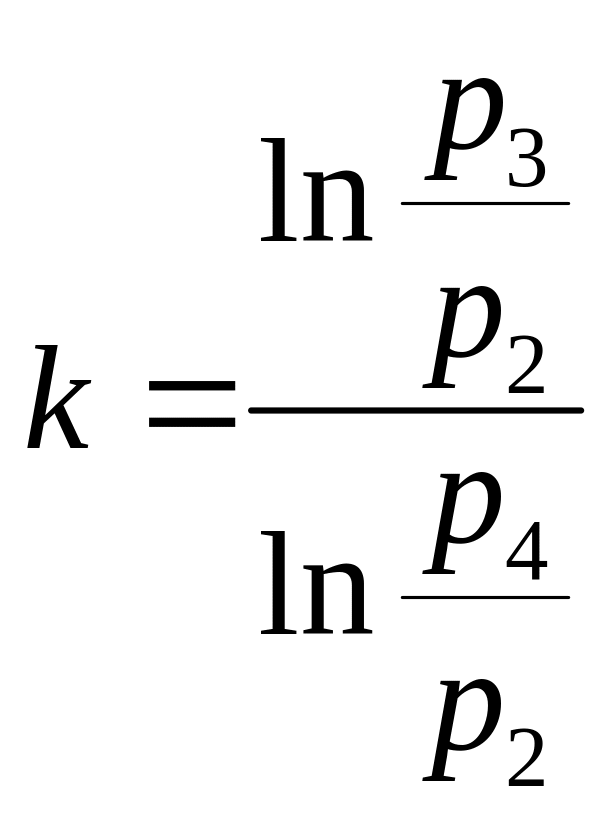 (3.15)
(3.15)
