- •Содержание
- •Тема «Строение вещества»
- •Тема «Виды химической связи»
- •Характеристика веществ с атомной и молекулярной кристаллическими решетками
- •22. Вопросы кроссворда.
- •Химическая связь
- •Дополнительные задания. Кристаллические и аморфные вещества
- •Типы химической связи
- •Тема «Полимеры, пластмассы» Ода пластмассам
- •3. О каком веществе идет речь?
- •Тема «Газообразное состояние вещества»
- •Природные газовые смеси – воздух и природный газ
- •Составные части воздуха
- •Представители газов (водород, углекислый газ, аммиак)
- •Способы распознавания газов
- •7. Кроссворд « Кислород. Оксиды. Горение»
- •8. Кроссворд «Водород»
- •Тема « Жидкое состояние вещества. Вода»
- •Тема «Твердое состояние вещества»
- •Кристаллические решетки
- •Характеристика агрегатных состояний веществ.
- •Тема «Дисперсные системы»
- •Тема «Массовая доля растворенного вещества»
Бюджетное образовательное учреждение Орловской области
среднего профессионального образования
«Орловский техникум технологии и предпринимательства им. В. А. Русанова»
Рабочая тетрадь
для самостоятельной работы студентов 1 курса
по учебной дисциплине «Химия»
Фамилия Кустов
Имя Владислав
Группа №17
г. Орел, 2014 год.
Аннотация.
Рабочая тетрадь по учебной дисциплине « Химия» разработана на тему «Строение вещества» преподавателем химии Зюковой Татьяной Владимировной.
Рабочая тетрадь включает информационный, тренировочный и контролирующий учебный материал.
Рабочая тетрадь – элемент коммуникативного общения студентов с преподавателем в процессе приобретения знаний, умений и навыков.
Студенты!
Самостоятельное систематическое выполнение заданий поможет Вам развить необходимые практические навыки в понимании и использовании основных положений и законов учебной дисциплины «Химия».
Для ответов на задания рабочей тетради необходимо хорошо изучить материал соответствующего параграфа учебника. Чтобы при заполнении тетради было меньше ошибок и не пришлось стирать или исправлять уже написанное не торопитесь и придерживайтесь правила: «Семь раз примерь, один раз отрежь». Вероятно, не на все вопросы вы сможете сразу найти ответ. Не огорчайтесь! Помните: «Кто ищет - тот всегда найдет!»
Желаю успеха! Дорогу осилит, идущий!
Содержание
1. Аннотация 2
2. Виды химической связи 3
3. Полимеры, пластмассы 12
4. Газообразное состояние вещества 15
5. Жидкое состояние вещества 23
6. Твердое состояние вещества 24
7. Дисперсные системы 27
8. Понятие массовой доли вещества 32
Тема «Строение вещества»
« Просто знать - еще не все, знания надо уметь использовать»
И. В. Гете.
Тема «Виды химической связи»
1. Химическая связь – это силы электрического притяжения, удерживающие атомы в веществах друг возле друга. Какие известны виды химической связи?
Химические связи бывают: ионная, ковалентная (неполярная и полярная), металлическая и водородная.
2. Объясните понятие об электронном облаке (энергетическом уровне) на примере атома водорода.
Электроны в атоме различаются энергией и располагаются слоями (энергетический уровень) вблизи ядра атома. Точное расположение конкретного электрона в каждый момент времени неопределенно. Однако можно говорить о вероятности нахождения электрона в некоторой области пространства (в электронном облаке или на энергетическом уровне) возле ядра атома. Первый электронный слой (ближний к ядру) вмещает 2 электрона, второй – 8 электронов, третий – 18 электронов. Особенность заполнения электронных слоев такова, что на внешнем (дальнем от ядра) слое может находиться не более 8 электронов. В водороде один энергетический уровень и на этом энергетическом уровне один электрон.
3. Что такое электроотрицательность атомов?
Электроотрицательность — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
4. Запишите определения понятий.
Ионная связь - очень прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
Катионы - положительно заряженный ион. Характеризуется величиной положительного электрического заряда.
Анионы - атом, или молекула, электрический заряд которой отрицателен, что обусловлено избытком электронов по сравнению с количеством положительных элементарных зарядов.
Ковалентная связь - химическая связь, образованная перекрытием пары валентных электронных облаков.
5. Механизм образования химической связи. Запишите схемы образования ионной связи между атомами: а) натрия и хлора; б) кальция и кислорода.
а) Na + Cl = NaCl
 -e =
-e =

 +e
=
+e
=
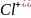
б) Ca + O = CaO
 -2e =
-2e =

 +2e
=
+2e
=

6. Какие виды химических связей существуют в простых веществах, а какие возникают при их взаимодействии между собой? Приведите примеры.
[H] + [H] = H – H (ковалентная неполярная связь),
Na – Na (металлическая связь),
Fe + S = FeS (ионная связь),
O2 + S = SO2 (ковалентная полярная связь).
7. Изобразите электронные формулы (с обозначением валентных электронов точками и размещением электронов, участвующих в образовании химических связей, между связываемыми атомами) молекул и ионных соединений: Н2, Н2О, NaCl.
 ,
,
 ,
,
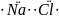
8. Приведите примеры, когда один и тот же элемент образует различные виды химической связи: ионную, ковалентную полярную и неполярную. Используйте электронные формулы.
Соединения брома с разными видами химической связи:
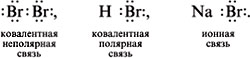
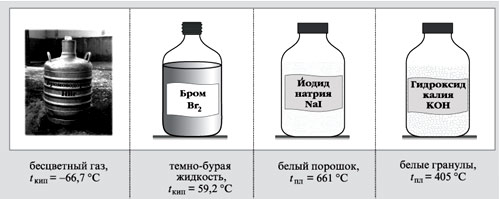
9. какие из веществ: НВr, Вr2, NaI, НNО3, NаNO3, КОН – имеют молекулярное, а какие – ионное строение?
Вещества с молекулярным строением – НВr, Вr2, НNО3,
Вещества ионного строения – NaI, NaNO3, KOH.
|
Вещества молекулярного и ионного строения |
10. Что можно сказать о температурах плавления и кипения веществ с ковалентной и ионной связью?
Температуры плавления и кипения веществ с ковалентной связью низкие, а с ионной связью – высокие.
11. Выберите формулы веществ, образованных ионной связью. Из букв, соответствующих правильным ответам, вы составите название одного из химических элементов, атомы которого имеют устойчивую электронную конфигурацию:
а) KCI --------------------------------------------------------------------------------------- Н
б) SO2 ------------------------------------------------------------------------------------- И
в) Na2O ------------------------------------------------------------------------------------ Е
г) Li3N ------------------------------------------------------------------------------------ О
д) PH3 ------------------------------------------------------------------------------------ А
г) CaF2 ----------------------------------------------------------------------------------- Н
ж) AI4C3 --------------------------------------------------------------------------------- Д
Ответ: Неон
12. Поиграйте в «крестики – нолики». Покажите выигрышный путь, который составляют пары химических элементов, между атомами которых образуется ионная связь.
О и О |
N и N |
S и S |
Na и O |
CI и H |
H и S |
K и F |
Ba и Br |
Li и O |
Составьте схемы образования ионной связи между химическими элементами, образующими выигрышный путь.
K + F = KF
Ba + Br = Ba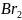
Li + O =

13. Механизм образования химической связи. Запишите схемы образования ковалентной связи между: а) двумя атомами водорода; б) атомами водорода и хлора.
а)H
+ H
=
 б)H
+ Cl
=HCl
б)H
+ Cl
=HCl
14. Отметьте, к какому типу связи – внутри- или межмолекулярной – следует отнести водородную связь. Между какими атомами она возникает? Приведите структурные формулы веществ с водородной связью.
Водородная связь – межмолекулярная, она возникает между атомами О, N или F одной молекулы и атомами водорода, связанными с атомами О, N или F, другой молекулы. Примеры:
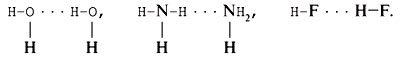
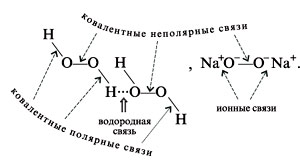
15. В пероксиде водорода Н2О2 и в пероксиде натрия Na2O2 имеются ковалентные полярные, ковалентные неполярные, водородные и ионные связи. Укажите на схеме их расположение:
.
16. При взаимодействии атомов неметаллов, имеющих различную электроотрицательность, возникает ковалентная полярная связь. Обычно чем больше разность электроотрицательностей связываемых атомов, тем более полярная связь. Расположите следующие химические связи в порядке возрастания их полярности:
Н–Сl, Н–Н, С–I, С–Н, С–Сl.
Мерой полярности химической связи служит ее дипольный момент, измеряемый в дебаях. В скобках после формулы вещества или ее фрагмента приведены значения разности электроотрицательностей атомов элементов и дипольных моментов в дебаях:
Н–Н (0, 0), С–Н (0,4, 0,4), Н–Сl (0,9, 1,0), С–I (0, 1,25), С–Сl (0,5, 1,5).

17. Поиграйте в « крестики – нолики». Покажите выигрышный путь, который составляют пары химических элементов, между атомами которых образуется ковалентная неполярная связь.
S и F |
S и S |
H и S |
K и CI |
Br и Br |
Na и S |
Mg и Mg |
O и O |
Li и Li |
Составьте схемы образования химической связи между элементами, образующими выигрышный путь.
18. Выберите формулы веществ, образованных ковалентной полярной связью. Из букв, соответствующих правильным ответам, вы составите название самого электроотрицательного элемента: - - - - .
а) CI2 ---------------------------------------------------------------------------------------- С
б) H2S ------------------------------------------------------------------------------------- Ф
в) O2 -------------------------------------------------------------------------------------- Е
г) CCI4 ---------------------------------------------------------------------------------- Т
д) PH3 ----------------------------------------------------------------------------------- О
е) BaF2 ----------------------------------------------------------------------------------- Л
ж) CO ---------------------------------------------------------------------------------- Р
Составьте схемы образования химической связи для двух веществ из тех, формулы которых вы выбрали.
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
19. Установите соответствие между типом кристаллической решетки и ее характеристикой представленной в таблице. Из букв, соответствующим правильным ответам, вы составите название одной из аллотропных модификаций углерода: - - - - - - - - .