
- •2 Билет.
- •3 Билет.
- •Естественное семейство галогенов
- •Щелочные металлы. Физические свойства
- •Химические свойства.
- •Химические свойства оснований.
- •Оксиды-сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2 .
- •Генетическая связь – это связь между веществами, которые относятся к разным классам Основные признаки генетических рядов:
- •Для натрия
- •2) Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли:
- •144Г масса 67,2м3 озона при н.У.
1 БИЛЕТ
Химия - это наука о веществах,их строении и свойствах,а также превращении одних веществ в другие. Химический элемент -это определенный вид атомов с одинаковым положительным зарядом ядра.Химический элемент существует в виде трех форм: 1) одиночный атом;2) простые вещества;3) сложные вещества или химические соединения. Вещества,образованные одним химическим элементом,называются простыми. Вещества,образованные несколькими химическими элементами,называются сложными
2 Билет.
Хемофилия — «любовь к химии». Хемофобия — «боязнь химии».
Химия и химические вещества играют огромную роль в природе и жизни человека. С химией непосредственно связаны различные химические процессы в живой и неживой природе, например выветривание скальных пород и сложные биохимические процессы: дыхание, синтез ДНК. Человек использует химические вещества как в быту так и на производстве, например моющие средства в быту и химические вещества при производстве металлов, химических волокон, лекарственных препаратов. Можно сказать, что без химии, как науки человек не смог бы жить, так как он живет, отсюда происходит хемофилия.
Отличительной чертой современной химии стало её тесное взаимодействие с другими естественными науками, в результате которого на стыке наук появились биохимия, геохимия и др. разделы. Одновременно с этим процессом интеграции интенсивно протекал и процесс дифференциации самой химии. Хотя границы между разделами химии достаточно условны, коллоидная и координационная химия, кристаллохимия и электрохимия, химия высокомолекулярных соединений и некоторые другие разделы приобрели черты самостоятельных наук.
Неизбежным следствием совершенствования химической теории в XX веке стали новые успехи практической химии — каталитический синтез аммиака, получение синтетических антибиотиков, полимерных материалов и т.п. Успехи химиков в деле получения вещества с желаемыми свойствами в числе прочих достижений прикладной науки к концу XX столетия привели к коренным преобразованиям в жизни человечества.
3 Билет.
Наука о веществах и их превращениях зародилась в Египте - технически наиболее передовой стране древнего мира. Египетские жрецы первые ученые-химики. Они владели многими не разгаданными химическими секретами. Например, приемы бальзамирования тел умерших фараонов и знати, а также получение некоторых красок.
По мнению известного историка химии, французского ученого М. Бертло, название «химия» происходит от слова «Хеми», или «Хума», которым древние египтяне называли свою страну, а также нильский чернозем (сравните с латинским словом «хумус» - грунт). Отсюда «химия» - черное, как земля, «египетское искусство», которое имеет дело с разными минералами, металлами. Такие отрасли производства, как гончарное производство, стеклоделие, крашение, парфюмерия, достигли в Египте значительного развития еще задолго до нашей эры. Химия считалась «божественной» наукой, находилась целиком в руках жрецов и тщательно скрывалась ими от всех непосвященных. Однако некоторые, сведения все же проникали за пределы Египта.
В Европу они частично попадали через Византию, а затем - через Испанию, после завоевания ее арабами в 711 году.
К концу XIX века состав университетов пополнился Варшавским, Киевским, Одесским и Томским. В России появились школы выдающихся математиков: Н. И. Лобачевского, П. Л. Чебышёва — А. А. Маркова, М. В. Остроградского, физиков: А. Г. Столетова и А. С. Попова, химиков: А. М. Бутлерова — В. В. Марковникова, Н. Н. Зинина, Ф. Ф. Бейльштейна, врачей: С. П. Боткина и Н. И. Пирогова, историков: Н. М. Карамзина, С. М. Соловьёва, В. О. Ключевского. Д. И. Менделеев открыл в 1869 году один из фундаментальных законов природы — периодический закон химических элементов.
4
Символы химических элементов (химические знаки) — условное обозначение химических элементов. Вместе с химическими формулами, схемами и уравнениями химических реакций образуют формальный язык химии — систему условных обозначений и понятий, предназначенную для краткой, ёмкой и наглядной записи и передачи химической информации.
5.
Атом является сложной системой, в состав которой входят определенные частицы. Английский физик Э. Резерфорд предложил ядерную (планетарную) модель строения атома. Основные положения ядерной модели атома.
1. Атом имеет форму шара, в центре которого находится ядро.
2. Ядро имеет очень маленький размер (диаметр атома 10-10 м, диаметр ядра ~10-15 м).
3. Ядро имеет положительный заряд.
4. Почти вся масса атома находится в ядре.
5. Вокруг ядра движутся электроны.
6. Электроны движутся вокруг ядра, как планеты вокруг Солнца.
Атомы одного элемента, которые имеют разные массовые числа, называются изотопами. Атомы изотопов одного элемента имеют одинаковое число протонов (Z) и отличаются друг от друга числом нейтронов (N). Изотопы обозначаются символами соответствующих элементов, слева от которых вверху записывают массовое число изотопа, а внизу — порядковый номер (заряд ядра атома) элемента. Например:12 6C — изотоп углерода с массовым числом 12; Иногда в символах изотопов записывают только массовые числа (12С, 18О, 27Al и т. д.) А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома. 6
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях). Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – квáнтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем – высокие. Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N – максимальное число электронов на уровне, n – номер уровня. Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
незавершенный энергетический уровень – это уровень, содержащий меньше максимального количества электронов.
Если внешняя оболочка атома полностью заполнена электронами, то атом имеет завершенный энергетический уровень.
7,
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Группа, или семейство, — одна из колонок периодической таблицы. Для групп, как правило, характерны более существенно выраженные периодические тенденции, нежели для периодов или блоков. Современные квантово-механические теории атомной структуры объясняют групповую общность тем, что элементы в пределах одной группы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках. Соответственно, элементы, которые принадлежат к одной и той же группе, традиционно располагают схожими химическими особенностями и демонстрируют явную закономерность в изменении свойств по мере увеличения атомного числа. Впрочем, в некоторых областях таблицы, например — в d-блоке и f-блоке, горизонтальные сходства могут быть столь же важны или даже более заметно выражены, нежели вертикальные.
В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
Меняется размер атома - сверху вниз в группе радиусы атомов увеличиваются!
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические свойства, т.е.
закономерность изменения химических свойств элементов и их соединений в группах:
В группах сверху вниз возрастают металлические свойства элементов
усиливаются основные свойства их соединений.
В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое при этом увеличивается;
3) электроотрицательность элементов = неметаллические свойства увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;
усиливаются кислотные свойства их соединений
8.
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
Таблица.Типы химической связи и их основные отличительные признаки.
Химическая связь |
Связываемые атомы |
Характер элементов |
Процесс в электронной оболочке |
Образующиеся частицы |
Кристаллическая решетка |
Характер вещества |
Примеры |
Ионная |
Атом металла и атом неметалла |
Электроположительный и электро отрицательный |
Переход валентных электронов |
Положительные и отрицательные ионы |
Ионная |
Солеобразный |
NaCl CaO NaOH |
Ковалентная |
Атомы неметаллов (реже-атомы металлов) |
Электроотрицательный реже электроположительный |
Образование общих электронных пар, заполнение молекулярных орбиталей |
Молекулы
|
Молекулярная
|
Летучий или нелетучий |
Br2 CO2C6H6 |
--------- |
Атомная |
Алмазоподоб ный |
Алмаз Si SiC |
||||
Металличес кая |
Атомы металлов |
Электроположительный |
Отдача валентных электронов |
Положительные ионы и электронный газ |
Металлическая |
Металлическая |
Металлы и сплавы |
9.
Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещния частиц называют узлами кристаллической решётки.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов.Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями. В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный материал.
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии.
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
10.
Под классификацией понимают объединение разнообразных и многочисленных соединений в определенные группы или классы, обладающие сходными свойствами. С проблемой классификации тесно связана проблема номенклатуры, т.е. системы названий этих веществ.Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ (элементарные, их, с учетом аллотропных модификаций, насчитывается около 400) и очень многочисленную группу сложных веществ (рисунок). Простые вещества состоят из одного элемента, в состав сложных входит два или более элементов. Простые вещества, в свою очередь разделяются на металлы и неметаллы.
Металлы отличаются характерным «металлическим» блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условия газообразны.
11.
Сложные вещества состоят из органических и неорганич. веществ. Неорганич. вещества - оксиды, гидроксиды, соли. Гидроксиды - кислоты, основания.
Кислоты, соли, основания, оксиды.
а) Кислоты: бескислородные и кислородсодержащие
б) соли: средние, кислые, основные, двойные, смешанные, комплексные.
в) основания: щёлочи и нерастворимые основания.
г) Оксиды:
1) несолеобразующие;
2) солеобразующие – а) основные б) амфотерные в) кислотные
Кислоты:
Бескислородные: HCl, HBr, HF
Кислородсодержащие: H2SiO3, H2SO4
Одно-:HCl, HJ
Двух-: H2SO3, H2S
Трехосновные: H3PO4
Летучие: HCl
Нелетучие: H2SO4
Устойчивые: H3PO4
Неустойчивые: H2CO3, H2SO3
Органические: CH3COOH
Неорганические: все вышеперечисленные, кроме уксусной
Основания:
Растворимые: NaOH, KOH
Нерастворимые: Fe(OH)2, Cu(OH)2
Одно - : NaOH, LiOH
Двух - : Ca(OH)2
Трехкислотные: Fe(OH)3, Cr(OH)3
Амфотерные: Zn(OH)2, Cr(OH)3
Оксиды:
Основные: Na2O, MgO, Fe2O3
Кислотные: SO2, SO3, P2O5
Несолеобразующие или безразличные: NO, N2O, CO, SiO
Соли:
Основные: ZnOHCl, (CuOH)2CO3
Кислотные: NaHCO3, KH2PO4
Растворимые: NaCl, Ba(NO3)2
Нерастворимые: BaSO4, AgCl
В быту применяются следующие щелочи: Гидроксид натрия, техническое название едкий натр или каустическая сода. Едкий натр кристаллическое вещество белого или желтоватого цвета, изготавливают в промышленности в виде гранул.Обладает сильнейшим моющим действием, хорошо растворяет жиры. Используется очистки масляных пятен с различных изделий, для прочистки от жировых отложений в канализационных трубах. Гидроксид кальция, техническое название-гашеная известь. Используется в строительстве для штукатурки стен внутри помещений, для побелки стен бытового и технического назначения.
Раствор аммиака (нашатырный спирт)-жидкость с раздражающим слизистые оболочки носа и глаз запахом. В быту используется 25% раствор. Применяется для стирки шерстяных изделий, для удаления пятен органического происхождения: молока, смол, жиров. Находит широкое применение в средствах для мытья стекол. Обладая хорошим моющим действием нашатырный спирт не оставляет разводов на поверхности. Раствор аммиака можно использовать для очистки изделий из золота и серебра, опуская их в нагретый раствор.
12.
Физическими явлениями называют такие явления, которые обнаруживаются посредством физических действий.
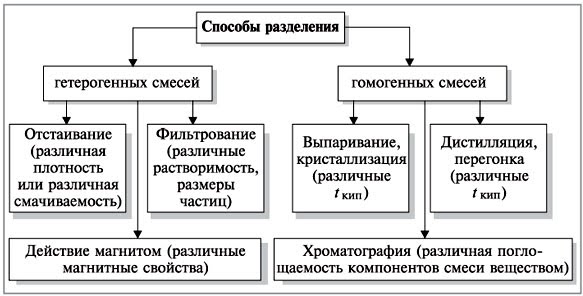 .
Перегонка, или дистилляция, лежит в
основе таких областей применения, как:
.
Перегонка, или дистилляция, лежит в
основе таких областей применения, как:
а) получение нефтепродуктов: бензина, керосина, лигроина, газойля из нефти;
б) получение отдельных составных частей из жидкого воздуха – кислорода, азота и т.д.;
в) получение дистиллированной воды для нужд фармакологии, лабораторий, систем охлаждения автомобилей.
2. Способ выпаривания, или кристаллизация, лежит в основе получения соли из озер, например Эльтона и Баскунчака, морской соли из морской воды и т.д.;
3. Способ фильтрования – это основа работы бытовой техники (пылесосов). Его используют хирурги (марлевые повязки), буровики и рабочие элеваторов (респираторные маски). С помощью чайного ситечка для фильтрования чаинок Остапу Бендеру из «Двенадцати стульев» удалось получить один из стульев у Эллочки Людоедки.
4. Способ отстаивания применяется наряду со способом фильтрования для очистки питьевой воды, для отделения нефти от воды.
13.
Классификация химических реакций. Химические реакции по изменению числа исходных и конечных веществ подразделяют на: 1. Реакции соединения - реакции, при которых из двух или нескольких веществ образуется одно новое вещество: NH3 + HCl = NH4Cl CaO + CO2 = CaCO3 2. Реакции разложения - реакции, в результате которых из одного вещества образуется несколько новых веществ: C2H5Br = C2H4 + HBr Hg(NO3)2 = Hg + 2NO2 + O2 3. Реакции замещения - реакции, в результате которых атомы простого вещества замещают в молекулах других веществ: Zn + CuSO4 = Cu + ZnSO4 Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O 4. Реакции обмена - реакции, в результате которых два вещества обмениваются атомами или группировками атомов, образуя два новых вещества: CaO + 2HCl = CaCl2 + H2O KCl + AgNO3 = AgClЇ + KNO3 По обратимости реакции делят на обратимые и необратимые. Реакции, протекающие в двух противоположных направлениях, называются обратимыми, а, соответственно, протекающие только в одном направлении - необратимыми. При необратимых реакций продукты реакции уходят из сферы реакции (выпадают в осадок, выделяются в виде газа), образуются малодиссоциирующее соединения или выделяется большое количество энергии
