
- •Часть II
- •Содержание
- •Лабораторная работа № 4
- •Ферменты
- •Отличие ферментов от неорганических катализаторов
- •Номенклатура и классификация ферментов
- •Коферменты
- •Свойства и функции коферментов
- •Специфичность ферментов
- •Изоферменты
- •Сравнительное действие ферментов и катализаторов неорганической природы
- •Лабораторная работа № 5
- •Активный центр фермента
- •Молекулярные механизмы ферментативного катализа
- •Мультисубстратные комплексы
- •Количественное определение ферментативной активности
- •Факторы, влияющие на активность ферментов
- •Регуляция каталитической активности ферментов
- •Регуляция путем изменения биосинтеза ферментов
- •Компартментализация ферментов в клетке
- •Лабораторная работа № 6
- •Кинетика ферментативных реакций
- •Уравнение Михаэлиса-Ментен
- •Графическое определение константы Михаэлиса (Кm)
- •Упростив уравнение, получаем:
- •Ингибирование активности ферментов
- •Конкурентное ингибирование аналогами субстрата
- •Графическая оценка констант конкурентного ингибирования
- •Бесконкурентное ингибирование
Коферменты
Подобно другим функциональным белкам, ферменты делятся на простые (однокомпонентные) и сложные (двухкомпонентные). Простые ферменты – это белки, построенные из аминокислот, и при гидролизе распадаются только на аминокислоты. К их числу относятся, например, гидролитические ферменты (пепсин, трипсин, уреаза). Сложные ферменты – это по сути сложные белки, содержащие, кроме, полипептидной цепи, небелковый компонент. При их гидролизе образуются не только свободные аминокислоты, но и небелковый фрагмент или продукты его распада.
Белковая часть сложного фермента получила название апофермента, небелковая часть – кофактора. Кофакторы могут иметь разную химическую природу и отличаться по прочности связи с апоферментом. Если кофактор прочно связан с апоферментом ковалентной связью, он называется простетической группой (FAD, FMN, биотин, пиридоксаль-5'-фосфат липоевая кислота). Простетическая группа обычно остаётся в составе фермента на всех стадиях каталитической реакции. Кофактор, который легко отделяется от апофермента и способен к самостоятельному существованию, называется коферментом. Апофермент удерживает кофермент нековалентными связями – водородными, электростатическими и др. Обычно кофермент связывается с апоферментом только во время катализа, после окончания реакции он покидает активный центр. Такими легко диссоциирующими коферментами являются коферменты-переносчики, действие которых связано с переходом от одной молекулы фермента к другой. Некоторые коферменты, например NAD, в зависимости от каталитических реакций, в которых они участвуют, могут функционировать как простетическая группа или покидать активный центр фермента.
Кофермент вместе с апоферментом образуют холофермент:
Кофермент + Апофермент ↔ Холофермент
Следует отметить одну отличительную особенность сложных ферментов, заключающуюся в том, что ни кофактор (в том числе кофермент), ни сам по себе апофермент каталитической активностью не обладают и только их объединение в единое целое обеспечивает быстрое протекание химической реакции.
Свойства и функции коферментов
Коферменты относятся к сложным органическим веществам, их молекулы значительно меньше по размеру, чем молекулы ферментов. Коферменты могут проникать через биологические мембраны, нагревание обычно не вызывает изменения их структуры.
Кофермент, локализуясь в каталитическом участке активного центра фермента, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. В ходе реакции кофермент претерпевает химические превращения, в точности противоположные тем, которые происходят в субстрате. Например, в окислительно-восстановительных реакциях молекула субстрата окисляется, а молекула кофермента восстанавливается. При последующих сопряжённых реакциях изменения в коферменте протекают в обратном направлении и он воспроизводится в первоначальной форме.
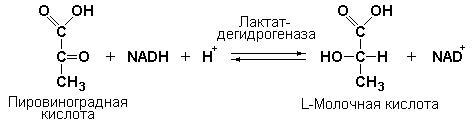
Таким образом, кофермент является одним из субстратов ферментативной реакции, т.е. выступает как косубстрат. По происхождению и химическому строению коферменты можно подразделить на следующие группы:
Производные витаминов (Е, К, Q, С, Н, В1, В2, В6, В12 и др);
Соединения нуклеотидной природы (NAD, NADP, АТP, CоА, FAD,FMN);
Гемы (простетические группы цитохромов, пероксидаз);
Убихинон, или коэнзим Q (перенос электронов и протонов в дыхательной цепи электронов);
Липоевая кислота;
Фосфоаденозилфосфосульфат (участвует в переносе сульфата);
S-аденозилметионин (SАМ) – донор метильной группы);
Глутатион (трипептид γ–глутамил-цистеинил-глицин участвует в окислительно-восстановительных реакциях).
Небелковая часть сложного фермента может быть представлена также ионами металлов (Mg2+, K+, Mn2+, Ca2+, Zn2+, Cu2+ и др.). Ферменты, содержащие в своём составе ионы металлов, называются металлоферментами. Например, α-амилаза включает ионы Са2+, которые участвуют в стабилизации пространственной структуры фермента. Удаление этих ионов приводит к потере активности фермента. Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТP, а комплекс Mg2+, АТP. В этом случае ион Mg2+, не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТP и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента.
