
- •IV Кинетический анализ сложных реакций Сложными называются такие реакции, в которых протекает несколько простых реакций, скорости которых независимы друг от друга.
- •- Параллельные
- •Основные постулаты, используемые при исследовании кинетики сложных реакций
- •Параллельные реакции
- •Тізбекті реакциялардың барлығы үш сатыдан тұрады:
- •Тізбектің сызықты үзілу жылдамдығы радикалдардың ыдыс қабырғасына қарай диффузиялану жылдамдығына және олардың (радикалдар) ыдыс немесе реактор қабырғасына адсорбциялану жылдамдығына тәуелді.
- •Б) тізбек ұзындығы тұрақты және уақыт бойынша өзгермейді.
- •Еру процесін химиялық реакция нәтижесінде қатты фазаның (а) мөлшері мен формасының өзгеруін ескере отырып қарастыру қажет.
- •Лекция 8 Катализ
- •Катализатордың жалпы қасиеттері:
- •Лекция 10 гетерогенді катализдік реакцияның кинетикасы. Ленгмюрдіњ адсорбциялыќ теориясы
- •К‰шті электролит ерітіндісі ‰шін:
- •Лекция 13 Дебай - Хюккельдің күшті электролиттер теориясы
- •Электродтыќ потенциалдыњ ерітінді ќ±рамына жєне температураѓа тєуелділігі
- •Потенциалдардыњ сутектік шкаласы
- •Тепе-теңдік электродтыќ потенциалдыњ тањбасы
- •Лекция 15 Гальваникалық элемент
- •Гальваникалыќ элементтіњ схемасын шартты т‰рде жазу
- •Қайтымды гальваникалық элемент үшін ток әрқашан солдан оңға қарай жүру және соңында бір металл болу керек.
- •- Кеуекті диафрагмма; 2 - цилиндр тєрізді мырыш электроды; 3 - мыс электроды.
- •Гальваникалыќ элементтіњ термодинамикасы
- •Егерде электрхимиялыќ элементте тµмендегідей ќайтымды жєне изотермиялыќ реакция ж‰ретін болса:
- •Гальваникалық элементтің термодинамикалық сипаттамалары
- •Срм сурактары
- •Химиялыќ гальваникалыќ элементке Даниэль - Якоби элементі жєне басќа элементтер жатады.
- •Әдетте электродтар жүретін электрохимиялық реакцияның жылдамдығы электрод арқылы өтетін тоқтың тығыздығымен сипатталады:
- •Кез келген электрохимиялық процесс бірнеше сатыдан тұрады:
- •Егер шектеуші массалар ауысу сатысы болса, онда электрохимиялық реакция диффузиялық режимде өтеді.
- •Алмасу тогы деп тепе-теңдік потенциал орнаған кездегі электродтық реакцияға қатысатын электр мөлшерін айтады.
- •Электрод потенциалының жүйеден өткен тоққа (і) тәуелділігін беретін қисықты поляризациялық қисық деп атайды (сурет).
- •Поляризацияның себебін электродтық процестің шектеуші сатысымен байланыстырады және осы себепті концентрациялық және электрохимиялық поляризацияға бөлінеді.
- •Концентрациялық поляризация электролиз бетіне потенциал анықтаушы иондардың диффузияланып келу сатысы шектеуші саты болған кезде туады.
- •Электрохиимиялық поляризация электрохимиялық реакцияның өзінің жылдамдығының төмендеуінен туады. Бұл жағдайда процестің жылдамдығы тоқ тығыздығымен (і) анықталады.
К‰шті электролит ерітіндісі ‰шін:
![]() .
.![]()
![]() ,
,
м±нда М1 - еріткіштіњ молярлыќ массасы; М2- еріген заттыњ молярлыќ массасы; - ерітіндініњ тыѓыздыѓы; 1 - еріткіштіњ тыѓыздыѓы; ,х - рационалдыќ активтілік коэффициенті, ал ,с жєне ,m - практикалыќ активтілік коэффициенттері.
Орташа иондыќ активтілік коэффициенттің физикалық мағынасы
Орташа
иондыќ активтілік коэффициенттіњ
µзіндік маѓнасы бар, ол электролиттер
‰шін мањызды сипаттама болып табылады.
Б±л ‰шін зарядталѓан бµлшектіњ (ионныњ)
реал ортадан идеал ортаѓа µту процесі
ќарастырылады. Б±л кезде реал жєне идеал
орталардаѓы ионныњ химиялыќ потенциалдарыныњ
айырмасына тењ ж±мыс (А) жасалынады,
демек
![]()
![]() .
Осыдан
.
Осыдан
![]() немесе
немесе
![]() ,
бұл
тењдеуден орташа иондыќ активтілік
коэффициенті ионныњ
реал ерітіндіден идеал ерітіндіге ауысу
ж±мысын
сипаттайтынын кµреміз.
,
бұл
тењдеуден орташа иондыќ активтілік
коэффициенті ионныњ
реал ерітіндіден идеал ерітіндіге ауысу
ж±мысын
сипаттайтынын кµреміз.
Ерітіндінің иондық күшінің ережесі
Электролиттердіњ орташа иондыќ активтілік коэффициенті () концентрацияѓа тєуелді, концентрация µскенде шамасы тµмендеп минимал мєнге жетіп, содан соњ ќайтадан µсіп 1-ге, кейде 1-ден де жоѓары болады. Орташа иондыќ активтілік коэффициентіне єрт‰рлі факторлардыњ єсерін Льюис жєне Рендал зерттеп, иондыќ к‰ш ережесі дейтін эмпирикалыќ ережені ±сынды: электролиттіњ с±йылтылѓан ерітіндісінде орташа иондыќ активтілік коэффициент ерітіндініњ иондыќ к‰шініњ функциясы және математикалыќ т‰рде былай жазылады:
![]() ,
,
м±нда А - пропорционалдыќ коэффициент; І – иондық күш:
![]() ,
,
мұнда zi - ион заряды; ci – ионның концентрациясы.
Б±л ереже концентрациясы 0,01-0,02 моль/кг-нан тµмен ерітінділер ‰шін орындалады, біраќ іс ж‰зінде 0,1-0,2 моль/кг концентрацияѓа дейін ќолдануѓа болады.
Электролит активтілігін оның концентрациясына ауыстыру
Ерітіндініњ иондыќ к‰ші т±раќты болса, оныњ орташа иондыќ активтілік коэффициенті де т±раќты, сондықтан активтілік орнына концентрацияны қолдануға болады, мысалы мына реакция үшін:
аА + вВ сС + dD, диссоциациялану константасын былай жазуға болады:

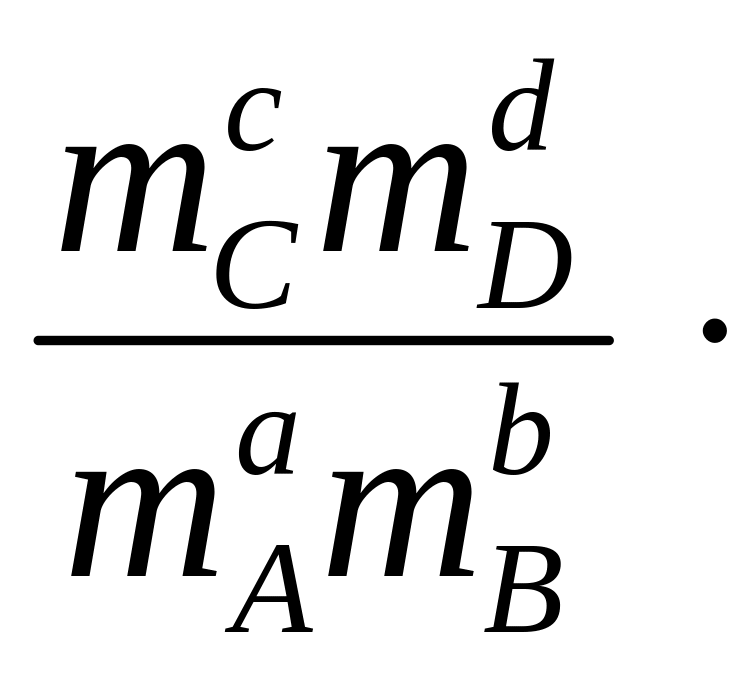



Ерітіндініњ иондыќ к‰шін т±раќты етіп ±стау ‰шін оѓан индиферентті (ерітіндідегі заттармен реакцияласпайтын) электролит ќосады.
Лекция 13 Дебай - Хюккельдің күшті электролиттер теориясы
1925 ж. Дебай жєне Хюккель (физиктер) к‰шті электролиттердіњ электростатикалыќ теориясын ±сынды.
Дебай-Хюккель теориясыныњ негіздері:
Дебай - Хюккель теориясында электролит толыѓымен диссоциацияланѓан (=1) деп ќарастырылады (сондыќтан б±л теория к‰шті электролиттерге ѓана ќолданылады).
Иондар ерітіндіде иондыќ атмосфера т‰зеді, олардыњ таралуы Больцман зањына баѓынады жєне иондар арасында тек электростатикалыќ к‰штер єсер етеді.
Иондыќ атмосферада иондардыњ заряды ‰здіксіз жєне оѓан Пуассон тењдеуі ќолданылады, б±л тењдеу ионныњ заряд тыѓыздыѓы () мен оныњ потенциалыныњ () байланысын кµрсетеді.
Еріткіштіњ ион жанындаѓы диэлектрлік т±раќтысы (ер-ш) оныњ ерітіндідегі диэлектрлік т±раќтысымен (ер-ді) бірдей.
Ион материалдыќ н‰кте, ол тек зарядымен ѓана сипатталады.
Иондық атмосфера
Иондыќ
атмосфера сфера тєрізді (сурет), ондаѓы
єр ион орталыќ ион бола алады, заряды
Ze.
Орталыќ ионды оѓан ќарсы зарядталѓан
иондар ќоршап т±рады. Иондыќ атмосфераныњ
иондыќ радиусы
![]() ,
м±нда -
иондыќ атмосфераныњ ќалыњдыѓы. Иондыќ
атмосфераныњ электростатикалыќ
потенциалы
тењ:
,
м±нда -
иондыќ атмосфераныњ ќалыњдыѓы. Иондыќ
атмосфераныњ электростатикалыќ
потенциалы
тењ:
![]() .
.

Сурет. Зарядтардыњ иондыќ атмосферада таралуы:
а -реалды иондыќ атмосферада; б -заряды баттасып жаѓылѓан; в - сфералыќ конденсатор моделінде; г - иондыќ атмосфераны жеке ионмен алмастырѓанда.
Дебай-Хюккель теориясыныњ ќаѓидалары
![]()
Б±л
тењдеу Дебай - Хюккель теориясыныњ
бірінші
жуыќтауы
деп аталады, м±ндаѓы
 ;
электролиттіњ судаѓы ерітіндісі ‰шін
298К-де жєне
= 78,4
болѓанда А=0,508.
;
электролиттіњ судаѓы ерітіндісі ‰шін
298К-де жєне
= 78,4
болѓанда А=0,508.
1:1 зарядты электролиттер ‰шін жоғарыда берілген тењдеудіњ ќолданылатын концентрация мєндері 0,001-0,01m дейін, иондыќ к‰штіњ мєндері де 0,001-0,01 дейін.
Дебай-Хюккель теориясыныњ ќолданылу шењберін кењейту ‰шін теория авторлары екінші жуыќтауын ±сынды, екінші жуыќтауында ион размерініњ єсері ескеріледі:
![]() ,
,
м±нда а - ионныњ размері, ол єрекеттесетін екі ионныњ ара ќашыќтыѓы (екі ион радиустарыныњ ќосындысы); В - т±раќты шама, ол сулы ерітінділер ‰шін 0,33 . 108 тењ.
Екінші жуыќтаудыњ ќолданылу концентрациясы m=0,01-0,1, иондыќ к‰ш І= 0,01-0,1.
Кейінірек, екінші жуыќтаудан кейін теорияныњ ‰шінші жуыќтауы ±сынылды. ‡шінші жуыќтауда иондардыњ поляризациясы жєне ерітіндініњ диэлектрлік т±раќтысы ескерілді:
![]() ,
,
м±нда С - т±раќты шама.
‡шінші жуыќтау б±рынѓылардан да кењірек концентрация аралыѓына ќолданылды: m=1-4.
Лекция 14
Электродтыќ потенциалды термодинамика тұрѓысынан түсіндіру
Электродтың тепе-теңдік потенциалы
Тотыѓу - тотыќсыздану реакциясы ж‰ретін электрод пен электрод батырылѓан ерітінді арасында, реакцияныњ тура жєне кері баѓыттарыныњ жыдамдыќтары тењескен жаѓдайда туатын электрлік потенциалды (электрлік єлует) тепе-тењдік электродтыќ потенциал деп атайды. Ќос электр ќабатыныњ єсерінен металл-ерітінді шекарасында заряд пайда болады.
¤зініњ т±зыныњ ерітіндісіне батырылѓан металл электродында тепе-тењдік жаѓдайда металл иондарыныњ электродтаѓы жєне ерітіндідегі химиялыќ потенциалдары бір-біріне тењеседі:
![]()
Электрохимический потенциал
Зарядталѓан бµлшектіњ (ионныњ) химиялыќ потенциалы электрхимиялыќ потенциал деп аталады, ол тењ
![]() ,
,
м±нда nF - заттыњ грамм-ионыныњ электр энергиясы; - берілген фазадаѓы зарядталѓан бµлшектіњ шексіз алыстатылѓан н‰ктеге немесе ќандай да бір басќа н‰ктеге ќатысты электрлік потенциалы.
Тепе - тењдік кезде электродта
![]() ,
,
м±нда / - зарядталѓан бµлшектіњ (металл ионыныњ) электродтаѓы электрлік потенциалы; // - оныњ ерітіндідегі электрлік потенциалы.
