
- •IV Кинетический анализ сложных реакций Сложными называются такие реакции, в которых протекает несколько простых реакций, скорости которых независимы друг от друга.
- •- Параллельные
- •Основные постулаты, используемые при исследовании кинетики сложных реакций
- •Параллельные реакции
- •Тізбекті реакциялардың барлығы үш сатыдан тұрады:
- •Тізбектің сызықты үзілу жылдамдығы радикалдардың ыдыс қабырғасына қарай диффузиялану жылдамдығына және олардың (радикалдар) ыдыс немесе реактор қабырғасына адсорбциялану жылдамдығына тәуелді.
- •Б) тізбек ұзындығы тұрақты және уақыт бойынша өзгермейді.
- •Еру процесін химиялық реакция нәтижесінде қатты фазаның (а) мөлшері мен формасының өзгеруін ескере отырып қарастыру қажет.
- •Лекция 8 Катализ
- •Катализатордың жалпы қасиеттері:
- •Лекция 10 гетерогенді катализдік реакцияның кинетикасы. Ленгмюрдіњ адсорбциялыќ теориясы
- •К‰шті электролит ерітіндісі ‰шін:
- •Лекция 13 Дебай - Хюккельдің күшті электролиттер теориясы
- •Электродтыќ потенциалдыњ ерітінді ќ±рамына жєне температураѓа тєуелділігі
- •Потенциалдардыњ сутектік шкаласы
- •Тепе-теңдік электродтыќ потенциалдыњ тањбасы
- •Лекция 15 Гальваникалық элемент
- •Гальваникалыќ элементтіњ схемасын шартты т‰рде жазу
- •Қайтымды гальваникалық элемент үшін ток әрқашан солдан оңға қарай жүру және соңында бір металл болу керек.
- •- Кеуекті диафрагмма; 2 - цилиндр тєрізді мырыш электроды; 3 - мыс электроды.
- •Гальваникалыќ элементтіњ термодинамикасы
- •Егерде электрхимиялыќ элементте тµмендегідей ќайтымды жєне изотермиялыќ реакция ж‰ретін болса:
- •Гальваникалық элементтің термодинамикалық сипаттамалары
- •Срм сурактары
- •Химиялыќ гальваникалыќ элементке Даниэль - Якоби элементі жєне басќа элементтер жатады.
- •Әдетте электродтар жүретін электрохимиялық реакцияның жылдамдығы электрод арқылы өтетін тоқтың тығыздығымен сипатталады:
- •Кез келген электрохимиялық процесс бірнеше сатыдан тұрады:
- •Егер шектеуші массалар ауысу сатысы болса, онда электрохимиялық реакция диффузиялық режимде өтеді.
- •Алмасу тогы деп тепе-теңдік потенциал орнаған кездегі электродтық реакцияға қатысатын электр мөлшерін айтады.
- •Электрод потенциалының жүйеден өткен тоққа (і) тәуелділігін беретін қисықты поляризациялық қисық деп атайды (сурет).
- •Поляризацияның себебін электродтық процестің шектеуші сатысымен байланыстырады және осы себепті концентрациялық және электрохимиялық поляризацияға бөлінеді.
- •Концентрациялық поляризация электролиз бетіне потенциал анықтаушы иондардың диффузияланып келу сатысы шектеуші саты болған кезде туады.
- •Электрохиимиялық поляризация электрохимиялық реакцияның өзінің жылдамдығының төмендеуінен туады. Бұл жағдайда процестің жылдамдығы тоқ тығыздығымен (і) анықталады.
Тізбекті реакциялардың барлығы үш сатыдан тұрады:
Тізбек туу сатысы, мысалы:
а) Cl2+h2Cl (сәулелену әсерінен)
б) C2H6![]() 2CH3
(термиялық ыдырау)
2CH3
(термиялық ыдырау)
в) CH4+O2 CH3 +HO2 (бимолекулалы соқтығысу)
г) қосымша ендірілген инициаторлардың (ынталандырғыштар) мысалы, пероксидтер RCOOCR2RCO, азоқосылыстар R-C-N N-C- R 2RC+N т.б. әсерінен
Тізбек жалғасу сатысы:
Cl +Н2НCl+Н
Н+Cl2 НCl+ Cl т.с.с.
Бұл сатыда тізбек буындарының кезектесіп қайталануы себебінен реакция өнімі түзіле бастайды.
Тізбек үзілуі. Тізбек үзілуі екі типке бөлінеді:
а) сызықты:
Cl
+ ыдыс қабырғасы
Cl(адс).
Бұл кезде жылдамдық
![]() ,
демек n=1.
,
демек n=1.
Тізбектің сызықты үзілу жылдамдығы радикалдардың ыдыс қабырғасына қарай диффузиялану жылдамдығына және олардың (радикалдар) ыдыс немесе реактор қабырғасына адсорбциялану жылдамдығына тәуелді.
б) квадратты үзілу:
мысалы, Cl
+Cl
Cl2,
![]() және n=2.
және n=2.
Бірнеше рет қайталанып
тізбекті процесс тудыратын сатыны
тізбектің
буыны деп атайды:
Cl
+Н2
және Н
+Cl2
;
![]() т.с.с.
т.с.с.
Тізбектің тууынан үзілуіне дейінгі буындардың саны тізбектің ұзындығы деп аталады.
Егер реакцияның қарапайым актсында бір радикалдан бір ғана радикал түзілетін болса, онда сызықты тізбекті реакция болады.
Бір радикалдан бірнеше радикал түзілетін болса тармақталған тізбекті реакция болады.
Сызықты тізбекті реакцияның кинетикасы
Сызықты тізбекті реакциялардың
кинетикасын зерттеуде стационарлық
концентрация әдісі (СКӘ) жиі қолданылады.
Мұны фосген СОCl2
түзілу реакциясының
мысалында мына реакция бойынша қарастыруға
болады: СО+Cl2СОCl2;
реакцияның теңдеуіне байланысты оның
реттілігі СО бойынша да және Cl2
бойынша да 1-ге тең болуы керек, бірақ
практикада nCO
=1, ал
![]() екені белгілі болады.
екені белгілі болады.
Осы реакцияның мүмкін болатын сатыларын жазайық:
Реакцияның
жалпы жылдамдығы (![]() )
үшінші
сатының жылдамдығымен анықталады,
себебі К3-тің
мәні жылдамдық константаларының бәрінен
өте кіші, (K3<<K1,K2,K4,K5),
сондықтан үшінші саты реакцияны тежеуші
(шектеуші, лимиттеуші) саты, яғни
)
үшінші
сатының жылдамдығымен анықталады,
себебі К3-тің
мәні жылдамдық константаларының бәрінен
өте кіші, (K3<<K1,K2,K4,K5),
сондықтан үшінші саты реакцияны тежеуші
(шектеуші, лимиттеуші) саты, яғни
![]() .
СКӘ әдісін қолдану үшін радикалдардың
концентрацияларының уақытқа байланысты
өзгерістерін реакцияның сатылары
бойынша жазайық:
.
СКӘ әдісін қолдану үшін радикалдардың
концентрацияларының уақытқа байланысты
өзгерістерін реакцияның сатылары
бойынша жазайық:
![]()
![]()
![]()
![]()
![]()
![]() (1)
(1)
![]()
![]()
![]()
![]()
![]() (2)
(2)
(1) және (2) - теңдеулерді қоссақ, одан
![]() (3)
(3)
Енді (2) және (3) - теңдеулерден СОCl – дың концентрациясын табады:
 (4)
(4)
Реакцияның жалпы жылдамдығын табуға арналған теңдеуге жоғарыда келтірілген [COCl ]-дың мәнін қойып келесі теңдеуді аламыз:
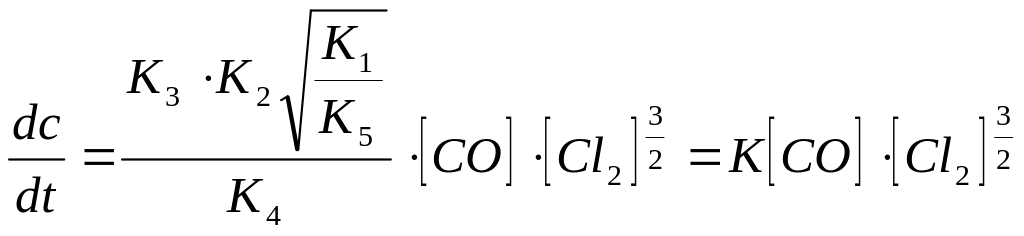 (5)
(5)
демек,
реакцияның реттілігі СО бойынша 1-ге,
Cl2,
бойынша 3/2-ке тең; мұнда К - барлық
константалардың қосындысы, яғни
![]() .
.
Сөйтіп, фосген молекуласының түзілу реакциясының мысалында сызықты тізбекті реакциялардың кинетикасын талдап зерттеудің мүмкіндігін көреміз.
Лекция 6
Тармақталған тізбекті реакцияның кинетикасы
Тармақталған тізбекті реакцияларды қарастыру - химиялық кинетиканың ең күрделі бөлімі. Тармақталған тізбекті реакцияны зерттеуде орыс оқымыстысы Н.Н. Семеновтың және оның мектебінің еңбектері зор. Өте қарапайым тармақталған тізбекті реакцияның кинетикасын мынадай шарттар орындалған жағдайда қарастыру керек:
а) бастапқы заттың концентрациясы тұрақты, сондықтан тізбектің пайда болу сатысындағы радикалдардың концентрациясы да тұрақты болады;
