
- •IV Кинетический анализ сложных реакций Сложными называются такие реакции, в которых протекает несколько простых реакций, скорости которых независимы друг от друга.
- •- Параллельные
- •Основные постулаты, используемые при исследовании кинетики сложных реакций
- •Параллельные реакции
- •Тізбекті реакциялардың барлығы үш сатыдан тұрады:
- •Тізбектің сызықты үзілу жылдамдығы радикалдардың ыдыс қабырғасына қарай диффузиялану жылдамдығына және олардың (радикалдар) ыдыс немесе реактор қабырғасына адсорбциялану жылдамдығына тәуелді.
- •Б) тізбек ұзындығы тұрақты және уақыт бойынша өзгермейді.
- •Еру процесін химиялық реакция нәтижесінде қатты фазаның (а) мөлшері мен формасының өзгеруін ескере отырып қарастыру қажет.
- •Лекция 8 Катализ
- •Катализатордың жалпы қасиеттері:
- •Лекция 10 гетерогенді катализдік реакцияның кинетикасы. Ленгмюрдіњ адсорбциялыќ теориясы
- •К‰шті электролит ерітіндісі ‰шін:
- •Лекция 13 Дебай - Хюккельдің күшті электролиттер теориясы
- •Электродтыќ потенциалдыњ ерітінді ќ±рамына жєне температураѓа тєуелділігі
- •Потенциалдардыњ сутектік шкаласы
- •Тепе-теңдік электродтыќ потенциалдыњ тањбасы
- •Лекция 15 Гальваникалық элемент
- •Гальваникалыќ элементтіњ схемасын шартты т‰рде жазу
- •Қайтымды гальваникалық элемент үшін ток әрқашан солдан оңға қарай жүру және соңында бір металл болу керек.
- •- Кеуекті диафрагмма; 2 - цилиндр тєрізді мырыш электроды; 3 - мыс электроды.
- •Гальваникалыќ элементтіњ термодинамикасы
- •Егерде электрхимиялыќ элементте тµмендегідей ќайтымды жєне изотермиялыќ реакция ж‰ретін болса:
- •Гальваникалық элементтің термодинамикалық сипаттамалары
- •Срм сурактары
- •Химиялыќ гальваникалыќ элементке Даниэль - Якоби элементі жєне басќа элементтер жатады.
- •Әдетте электродтар жүретін электрохимиялық реакцияның жылдамдығы электрод арқылы өтетін тоқтың тығыздығымен сипатталады:
- •Кез келген электрохимиялық процесс бірнеше сатыдан тұрады:
- •Егер шектеуші массалар ауысу сатысы болса, онда электрохимиялық реакция диффузиялық режимде өтеді.
- •Алмасу тогы деп тепе-теңдік потенциал орнаған кездегі электродтық реакцияға қатысатын электр мөлшерін айтады.
- •Электрод потенциалының жүйеден өткен тоққа (і) тәуелділігін беретін қисықты поляризациялық қисық деп атайды (сурет).
- •Поляризацияның себебін электродтық процестің шектеуші сатысымен байланыстырады және осы себепті концентрациялық және электрохимиялық поляризацияға бөлінеді.
- •Концентрациялық поляризация электролиз бетіне потенциал анықтаушы иондардың диффузияланып келу сатысы шектеуші саты болған кезде туады.
- •Электрохиимиялық поляризация электрохимиялық реакцияның өзінің жылдамдығының төмендеуінен туады. Бұл жағдайда процестің жылдамдығы тоқ тығыздығымен (і) анықталады.
Алмасу тогы деп тепе-теңдік потенциал орнаған кездегі электродтық реакцияға қатысатын электр мөлшерін айтады.
Сөйтіп, кинетикалық режимде өтетін электрохимиялық реакцияның жылдамдығы алмасу тогы бойынша жалпы түрде былай жазылады:
![]() (9)
(9)
![]() (10)
(10)
Электродтық поляризация деп электрохимиялық жүйеден тұрақты тоқ өткен кезде электрод потенциалының өзінің тепе - теңдік мәнінен ауытқуын айтады.
Идеал поляризацияланбайтын электродтар
Егер электрохимиялық жүйеден өткен тұрақты тоқ электрохимиялық реакцияға ғана жұмсалып, қос электрлік қабаттың құрылысын бұзбайтын болса мұндай электродтарды идеал поляризацияланбайтын деп атайды.
Идеал поляризацияланатын электродтар
Ал егер жүйеден өткен тоқ электрохимиялық реакциямен қоса, қос электрлік қабаттың құрылысының бұзылуына да қатысатын болса, онда мұндай электродтар поляризацияланатын электродтар деп аталады.
Жалпы алғанда, барлық электродтар әртүрлі дәрежеде поляризацияға ұшырайды.
Поляризациялық қисықтар
Электрод потенциалының жүйеден өткен тоққа (і) тәуелділігін беретін қисықты поляризациялық қисық деп атайды (сурет).
Сурет. Катодта сутек бөлінуінің поляризациялық қисығы
Поляризацияға
катод ұшыраған жағдайда, яғни катодтық
поляризация
болса, онда электрод потенциалының мәні
теріс мәндерге ауытқиды, ол кезде
поляризация былай жазылады:
![]() .
.
Поляризацияға
анод ұшыраған жағдай - анодтық
поляризация,
электрод потенциалы оң мәндерге ауытқиды,
сөйтіп
![]() .
.
Поляризацияның себебі
Поляризацияның себебін электродтық процестің шектеуші сатысымен байланыстырады және осы себепті концентрациялық және электрохимиялық поляризацияға бөлінеді.
Концентрациялық поляризация
Концентрациялық поляризация электролиз бетіне потенциал анықтаушы иондардың диффузияланып келу сатысы шектеуші саты болған кезде туады.
Потенциал анықтаушы иондардың диффузия жылдамдығы электрохимиялық реакцияның жылдамдығынан аз болған жағдайда электрод бетінде таралуын сызба-нұсқа ретінде қарастыруға болады (сурет).
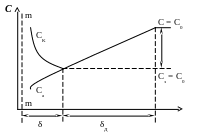
Сурет. Потенциал анықтаушы иондар концентрациясының диффузиялық поляризация кезіндегі өзгерісі
мұнда -қос электр қабаттың (ҚЭҚ) қалыңдығы; D – “+” және “-“ зарядты бөлшектер жылу қозғалысында болатын диффузиялық қабат, ол ҚЭҚ-ның диффузиялық бөлігінен басқаша; Сэ - ҚЭҚ жанындағы иондардың концентрациясы; С0 - иондардың ерітіндегі жалпы концентрациясы.
Концентрациялық поляризация потенциал анықтаушы иондардың электродтағы концентрациясының өзгеруімен байланысты. Ол поляризация Фиктің екінші теңдеуінен анықталатын диффузиялық тоқпен сипатталады:
![]() (1)
(1)
Осы (1)-теңдеуден иондардың қос электр қабаты жанындағы концентрациясын табамыз:
![]() (2)
(2)
Концентрациялық поляризацияда СЭ әр уақытта С0-ден кіші болатынын (2)-теңдеуден көреміз, диффузиялық тоқтың тығыздығы (іD) көп болған сайын бұл айырмашылық та көп болады, бұл кезде электродтық потенциал Сэ және С0-ге тәуелді. Тепе-теңдік кездегі электродтық потенциал:
т-т=
0
+![]() ,
(3)
,
(3)
ал ток жүрген кездегі потенциал;
і
= 0
+![]() (4)
(4)
Сонда концентрациялық поляризация (Yк) былай жазылады:
![]() ,
(5)
,
(5)
демек Yк = f(Сэ, С0) екенін көреміз.
Электрохимиялық поляризация
