
- •1 Хімічна термодинаміка 4
- •2 Дисперсні системи 32
- •3 Поверхневі явища 64
- •1 Хімічна термодинаміка
- •1.1 Основи фізичної хімії. Хімічна термодинаміка
- •1.1.1 Основні поняття і терміни хімічної термодинаміки
- •1.1.2 Перший закон термодинаміки
- •1.1.3 Теплові ефекти фізико – хімічних процесів
- •1.1.3.1 Розрахунки теплових ефектів
- •1.1.4 Висновки з закону Гесса
- •1.1.5 Залежність теплового ефекту процесу від температури
- •1.2 Напрямок перебігу фізико – хімічних процесів
- •1.2.1 Другий закон термодинаміки
- •1.2.2 Ентропія
- •1.2.3 Третій постулат термодинаміки
- •1.2.4 Зміна ентропії у фізико-хімічних процесах
- •1.2.5 Вільна енергія і напрямок хімічних реакцій
- •Приклади рішення задач
- •Розв’язок
- •Відповідь: 159,9 Дж/моль·к.
- •2 Дисперсні системи
- •2.1 Класифікація дисперсних систем
- •2.1.1 Основні терміни колоїдної хімії
- •2.1.2 Класифікація дисперсних систем
- •2.1.2.1 За характером дисперсності
- •2.1.2.2 За ступенем дисперсності
- •2.1.2.3 За агрегатним станом дисперсної фази і дисперсійного середовища
- •2.1.2.4 За характером взаємодії між частинками дисперсної фази і дисперсійним середовищем
- •2.1.2.5 За характером взаємодії між самими частинками дисперсної фази
- •2.1.2.6 За формою частинок дисперсної фази (за топографічною ознакою)
- •2.1.3 Одержання і очистка дисперсних систем
- •2.1.3.1 Основні методи одержання дисперсних систем
- •2.1.3.2 Очистка колоїдних систем
- •2.2 Молекулярно-кінетичні властивості дисперсних систем
- •2.2.1 Броунівський рух
- •2.2.2 Дифузія
- •2.2.3 Осмотичний тиск
- •2.2.4 Седиментація
- •2.2.4.1 Седиментаційно-дифузійна рівновага
- •2.2.4.2 Седиментаційний аналіз
- •2.2.5 Оптичні властивості дисперсних систем
- •2.2.5.1 Розсіяння світла
- •2.2.5.2 Оптичні методи дослідження дисперсних систем
- •Контрольні питання
- •Приклади розв’язку задач
- •3.1.2 Поверхневий натяг
- •3.1.3 Класифікація поверхневих явищ
- •3.1.4 Поверхневий натяг на межі двох рідин. Взаємне розтікання рідин
- •3.1.5 Адгезія і когезія. Явища розтікання та змочування
- •3.1.5.1 Поняття про когезію та адгезію
- •3.1.5.2 Змочування поверхні твердого тіла рідиною
- •3.1.5.3 Адгезія між твердим тілом і рідиною
- •3.1.5.4 Капілярні явища
- •Контрольні питання
- •3.2 Поверхневі явища на межі тверде тіло – газ, тверде тіло – рідина, рідина – газ, рідина – рідина, тверде тіло – рідина, тверде тіло – тверде тіло
- •3.2.1 Кількісна характеристика адсорбції. Величини адсорбції
- •3.2.2 Рівняння стану адсорбції
- •3.2.3 Теплота адсорбції
- •3.2.4 Залежність адсорбції від температури та природи газу
- •3.2.5 Фізична адсорбція газів і парів на гладкій твердій поверхні. Закон Генрі
- •3.2.6 Теорія адсорбції і рівняння Ленгмюра
- •3.2.7 Ізотерма адсорбції Фрейндліха
- •3.2.8 Рівняння бет (Брунауера,Еммета,Теллера)
- •Аналогічно
- •3.2.9 Швидкість адсорбції
- •3.2.10 Хімічна адсорбція газів на твердій гладкій і пористій поверхні
- •3.2.11 Капілярна конденсація
- •Отже, при сталій температурі
- •Контрольні питання
- •3.3 Електричні явища на межі тверде тіло – рідина. Будова міцели
- •3.3.1 Електрокінетичні явища
- •3.3.2 Утворення і будова подвійного електричного шару на межі тверде тіло – рідина
- •3.3.2.1 Механізм утворення пеш
- •3.3.2.2 Термодинамічне співвідношення між поверхневим натягом і електричним потенціалом
- •3.3.2.3 Теорія будови пеш Гельмгольца-Перрена
- •3.3.2.4 Теорія будови пеш Гуї-Чепмена
- •3.3.2.5 Теорія будови пеш Штерна
- •3.3.3 Вирази для дзета-потенціалу
- •3.3.4 Вплив різних факторів на дзета-потенціал
- •3.3.4.1 Вплив індиферентних електролітів
- •3.3.4.2 Вплив неіндиферентних електролітів
- •3.3.4.3 Вплив pH-середовища
- •3.3.4.4 Вплив концентрації колоїдної системи
- •3.3.4.5 Вплив температури
- •3.3.4.6 Вплив природи дисперсійного середовища
- •3.3.5 Міцелярна теорія колоїдних розчинів
- •3.3.6 Йонна адсорбція з розчинів на твердому адсорбенті
- •3.3.6.1 Йонообмінна адсорбція
- •3.4 Стійкість дисперсних систем
- •3.4.1 Види стійкості дисперсних систем
- •3.4.2 Процеси, обумовлені агрегативною нестійкістю
- •3.4.3 Фактори стійкості дисперсних систем
- •3.4.4 Коагуляція гідрофобних золів
- •3.4.4.1 Коагуляція під дією електролітів. Правило Шульце−Гарді
- •3.4.4.2 Гетерокоагуляція. Взаємна коагуляція золів
- •3.4.5 Теорії стійкості і коагуляції
- •3.4.5.1 Адсорбційна теорія коагуляції г.Фрейндліха
- •3.4.5.2 Електростатична теорія коагуляції г.Мюллера
- •3.4.5.3 Теорія стійкості систем длфо
- •3.4.5.4. Вплив концентрації електроліту на потенціальні криві взає-модії частинок
- •3.4.6 Швидкість коагуляції
- •3.4.7 Колоїдний захист
- •Контрольні питання
- •Розв’язок
- •Розв’язок
- •3.5 Характеристика мікрогетерогенних дисперних систем План
- •Металокерамічні матеріали
- •3.5.1 Дисперсні системи з газовим дисперсійним середовищем (аерозолі)
- •3.5.2 Дисперсні системи з рідинним дисперсійним середовищем
- •3.5.2.1 Суспензії
- •3.5.2.2 Емульсії
- •3.5.2.3 Латекси
- •3.5.3 Дисперсні системи з твердим дисперсійним середовищем (тверді золі, солідозолі)
- •3.5.3.1 Дисперсні системи з твердим дисперсійним середовищем і газоподібною дисперсною фазою (тверді піни)
- •3.5.3.2 Дисперсні системи з твердим дисперсійним середовищем і рідинною дисперсною фазою (тверді емульсії)
- •3.5.3.3 Дисперсні системи з твердим дисперсійним середовищем і твердою дисперсною фазою
- •3.5.4 Композиційні матеріали (композити)
- •3.5.4.1 Металокерамічні матеріали
3.3.3 Вирази для дзета-потенціалу
У найпростіших випадках, коли відсутні явища, що ускладнюють процес, зв’язок між дзета-потенціалом (кількісною характеристикою електрокінетичного явища) і параметрами стану системи визначаються рівняннями:
а) у випадку електрофорезу
![]() ;
;
б) у випадку електроосмосу
![]() ;
;
в) у випадку потенціалу протікання
![]() ,
,
де
![]() – лінійна швидкість електрофорезу при
градієнті потенціалу
– лінійна швидкість електрофорезу при
градієнті потенціалу
![]() ;
– об’ємна швидкість електроосмосу при
силі струму в системі, що дорівнює
;
– об’ємна швидкість електроосмосу при
силі струму в системі, що дорівнює
![]() ;
;
![]() – потенціал протікання, який виникає
при перепаді тиску
– потенціал протікання, який виникає
при перепаді тиску
![]() ;
;
![]() – в’язкість;
– питома електропровідність;
– в’язкість;
– питома електропровідність;
![]() – діелектрична провідність дисперсного
середовища;
– діелектрична провідність дисперсного
середовища;
![]() – діелектрична стала.
– діелектрична стала.
3.3.4 Вплив різних факторів на дзета-потенціал
Оскільки дзета-потенціал у багатьох випадках є величиною, що характеризує стабільність колоїдної системи, дуже важливо розглянути вплив на нього таких факторів, як введення в систему електролітів, зміна pH, концентрації розчину, температури тощо.
3.3.4.1 Вплив індиферентних електролітів
Індиферентні електроліти – це такі електроліти, які не мають йонів, здатних добудовувати кристалічну гратку колоїдної частинки.
Як уже було сказано вище, при розгляді теорії Гуї-Чепмена індиферентні електроліти не можуть суттєво змінити величину загального стрибка потенціалу колоїдних частинок. Дзета-потенціал вони знижують в результаті збільшення концентрації протийонів і стиснення ПЕШ (рис.3.28). В граничному випадку товщина ПЕШ може стати рівною товщині адсорбційного шару, а дзета-потенціал стає рівним нулю (ізоелектричний стан системи).
3.3.4.2 Вплив неіндиферентних електролітів
Вплив електроліту, один з йонів якого здатний добудовувати кристалічну гратку дисперсної фази, полягає в тому, що потенціалвизначальний йон цього електроліту може підвищувати потенціал , а йон, що був введений в парі з ним, і однойменний з зарядом протийону, здатний стискати ПЕШ, а, отже, зменшувати дзета-потенціал. При малих концентраціях неіндиферентного електроліту проявляється, здебільшого, перша тенденція, пов’язана з поверхневою дією йона, здатного добудовувати кристалічну гратку.
П
Рисунок
3.30 − Вплив неіндиферентного електроліту
на
і
-потенціали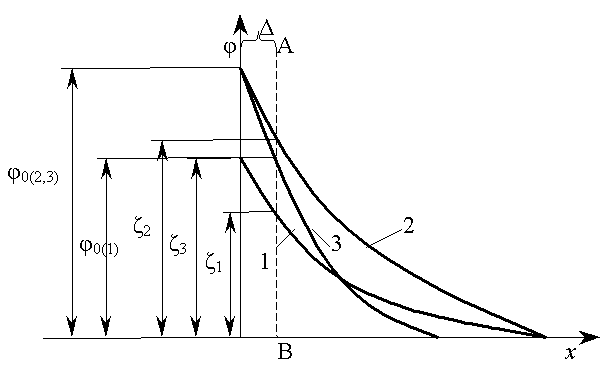
3.3.4.3 Вплив pH-середовища
Значення pH дисперсійного середовища може сильно впливати на дзета-потенціал колоїдних частинок, оскільки H+ і OH– йони володіють високою здатністю адсорбуватись: перші – завдяки малому радіусу, що дає змогу їм близько підходити до поверхні твердої фази, другі – внаслідок великого дипольного моменту.
3.3.4.4 Вплив концентрації колоїдної системи
Виходячи із загальних уявлень, можна передбачити, що при розведенні всякої колоїдної системи дзета-потенціал повинен зростати, оскільки товщина ПЕШ збільшується в результаті зменшення концентрації протийонів у системі. Разом з тим, при розведенні може спостерігатися десорбція потенціалвизначального йона з поверхні дисперсної фази, що повинно призводити до падіння - й відповідно дзета-потенціалу.
Концентрування колоїдного розчину зумовлює, зазвичай, протилежний ефект. В якому напрямку у підсумку зміниться дзета-потенціал при зміні концентрації колоїдної системи, визначається тим, вплив якого з двох факторів – розширення (стиснення) ПЕШ чи десорбція (адсорбція) потенціалвизначальних йонів в даному конкретному випадку виявиться сильнішим.
