
- •1 Хімічна термодинаміка 4
- •2 Дисперсні системи 32
- •3 Поверхневі явища 64
- •1 Хімічна термодинаміка
- •1.1 Основи фізичної хімії. Хімічна термодинаміка
- •1.1.1 Основні поняття і терміни хімічної термодинаміки
- •1.1.2 Перший закон термодинаміки
- •1.1.3 Теплові ефекти фізико – хімічних процесів
- •1.1.3.1 Розрахунки теплових ефектів
- •1.1.4 Висновки з закону Гесса
- •1.1.5 Залежність теплового ефекту процесу від температури
- •1.2 Напрямок перебігу фізико – хімічних процесів
- •1.2.1 Другий закон термодинаміки
- •1.2.2 Ентропія
- •1.2.3 Третій постулат термодинаміки
- •1.2.4 Зміна ентропії у фізико-хімічних процесах
- •1.2.5 Вільна енергія і напрямок хімічних реакцій
- •Приклади рішення задач
- •Розв’язок
- •Відповідь: 159,9 Дж/моль·к.
- •2 Дисперсні системи
- •2.1 Класифікація дисперсних систем
- •2.1.1 Основні терміни колоїдної хімії
- •2.1.2 Класифікація дисперсних систем
- •2.1.2.1 За характером дисперсності
- •2.1.2.2 За ступенем дисперсності
- •2.1.2.3 За агрегатним станом дисперсної фази і дисперсійного середовища
- •2.1.2.4 За характером взаємодії між частинками дисперсної фази і дисперсійним середовищем
- •2.1.2.5 За характером взаємодії між самими частинками дисперсної фази
- •2.1.2.6 За формою частинок дисперсної фази (за топографічною ознакою)
- •2.1.3 Одержання і очистка дисперсних систем
- •2.1.3.1 Основні методи одержання дисперсних систем
- •2.1.3.2 Очистка колоїдних систем
- •2.2 Молекулярно-кінетичні властивості дисперсних систем
- •2.2.1 Броунівський рух
- •2.2.2 Дифузія
- •2.2.3 Осмотичний тиск
- •2.2.4 Седиментація
- •2.2.4.1 Седиментаційно-дифузійна рівновага
- •2.2.4.2 Седиментаційний аналіз
- •2.2.5 Оптичні властивості дисперсних систем
- •2.2.5.1 Розсіяння світла
- •2.2.5.2 Оптичні методи дослідження дисперсних систем
- •Контрольні питання
- •Приклади розв’язку задач
- •3.1.2 Поверхневий натяг
- •3.1.3 Класифікація поверхневих явищ
- •3.1.4 Поверхневий натяг на межі двох рідин. Взаємне розтікання рідин
- •3.1.5 Адгезія і когезія. Явища розтікання та змочування
- •3.1.5.1 Поняття про когезію та адгезію
- •3.1.5.2 Змочування поверхні твердого тіла рідиною
- •3.1.5.3 Адгезія між твердим тілом і рідиною
- •3.1.5.4 Капілярні явища
- •Контрольні питання
- •3.2 Поверхневі явища на межі тверде тіло – газ, тверде тіло – рідина, рідина – газ, рідина – рідина, тверде тіло – рідина, тверде тіло – тверде тіло
- •3.2.1 Кількісна характеристика адсорбції. Величини адсорбції
- •3.2.2 Рівняння стану адсорбції
- •3.2.3 Теплота адсорбції
- •3.2.4 Залежність адсорбції від температури та природи газу
- •3.2.5 Фізична адсорбція газів і парів на гладкій твердій поверхні. Закон Генрі
- •3.2.6 Теорія адсорбції і рівняння Ленгмюра
- •3.2.7 Ізотерма адсорбції Фрейндліха
- •3.2.8 Рівняння бет (Брунауера,Еммета,Теллера)
- •Аналогічно
- •3.2.9 Швидкість адсорбції
- •3.2.10 Хімічна адсорбція газів на твердій гладкій і пористій поверхні
- •3.2.11 Капілярна конденсація
- •Отже, при сталій температурі
- •Контрольні питання
- •3.3 Електричні явища на межі тверде тіло – рідина. Будова міцели
- •3.3.1 Електрокінетичні явища
- •3.3.2 Утворення і будова подвійного електричного шару на межі тверде тіло – рідина
- •3.3.2.1 Механізм утворення пеш
- •3.3.2.2 Термодинамічне співвідношення між поверхневим натягом і електричним потенціалом
- •3.3.2.3 Теорія будови пеш Гельмгольца-Перрена
- •3.3.2.4 Теорія будови пеш Гуї-Чепмена
- •3.3.2.5 Теорія будови пеш Штерна
- •3.3.3 Вирази для дзета-потенціалу
- •3.3.4 Вплив різних факторів на дзета-потенціал
- •3.3.4.1 Вплив індиферентних електролітів
- •3.3.4.2 Вплив неіндиферентних електролітів
- •3.3.4.3 Вплив pH-середовища
- •3.3.4.4 Вплив концентрації колоїдної системи
- •3.3.4.5 Вплив температури
- •3.3.4.6 Вплив природи дисперсійного середовища
- •3.3.5 Міцелярна теорія колоїдних розчинів
- •3.3.6 Йонна адсорбція з розчинів на твердому адсорбенті
- •3.3.6.1 Йонообмінна адсорбція
- •3.4 Стійкість дисперсних систем
- •3.4.1 Види стійкості дисперсних систем
- •3.4.2 Процеси, обумовлені агрегативною нестійкістю
- •3.4.3 Фактори стійкості дисперсних систем
- •3.4.4 Коагуляція гідрофобних золів
- •3.4.4.1 Коагуляція під дією електролітів. Правило Шульце−Гарді
- •3.4.4.2 Гетерокоагуляція. Взаємна коагуляція золів
- •3.4.5 Теорії стійкості і коагуляції
- •3.4.5.1 Адсорбційна теорія коагуляції г.Фрейндліха
- •3.4.5.2 Електростатична теорія коагуляції г.Мюллера
- •3.4.5.3 Теорія стійкості систем длфо
- •3.4.5.4. Вплив концентрації електроліту на потенціальні криві взає-модії частинок
- •3.4.6 Швидкість коагуляції
- •3.4.7 Колоїдний захист
- •Контрольні питання
- •Розв’язок
- •Розв’язок
- •3.5 Характеристика мікрогетерогенних дисперних систем План
- •Металокерамічні матеріали
- •3.5.1 Дисперсні системи з газовим дисперсійним середовищем (аерозолі)
- •3.5.2 Дисперсні системи з рідинним дисперсійним середовищем
- •3.5.2.1 Суспензії
- •3.5.2.2 Емульсії
- •3.5.2.3 Латекси
- •3.5.3 Дисперсні системи з твердим дисперсійним середовищем (тверді золі, солідозолі)
- •3.5.3.1 Дисперсні системи з твердим дисперсійним середовищем і газоподібною дисперсною фазою (тверді піни)
- •3.5.3.2 Дисперсні системи з твердим дисперсійним середовищем і рідинною дисперсною фазою (тверді емульсії)
- •3.5.3.3 Дисперсні системи з твердим дисперсійним середовищем і твердою дисперсною фазою
- •3.5.4 Композиційні матеріали (композити)
- •3.5.4.1 Металокерамічні матеріали
3.3.2.5 Теорія будови пеш Штерна
Сучасна
теорія будови ПЕШ основана на уявленнях
Штерна (1834 р.) і об’єднує
дві попередні теорії. Згідно з цією
теорією шар протийонів складається
з двох частин (рис.3.27). Одна частина
знаходиться в безпосередній близькості
до міжфазної поверхні і утворює шар
Гельмгольца (адсорбційна частина ПЕШ)
товщиною
![]() ,
не більше діаметра гідратованих йонів,
що його утворюють. Друга частина
протийонів знаходиться за шаром
Гельмгольца в дифузній частині (дифузний
шар Гуї з потенціалом
,
не більше діаметра гідратованих йонів,
що його утворюють. Друга частина
протийонів знаходиться за шаром
Гельмгольца в дифузній частині (дифузний
шар Гуї з потенціалом
![]() )
і товщиною
)
і товщиною
![]() ,
яка може бути значною, і залежить від
властивостей і складу системи. Потенціал
в дифузній частині ПЕШ не може залежати
лінійно від відстані, оскільки йони в
ньому розподілені нерівномірно.
,
яка може бути значною, і залежить від
властивостей і складу системи. Потенціал
в дифузній частині ПЕШ не може залежати
лінійно від відстані, оскільки йони в
ньому розподілені нерівномірно.
У відповідності з прийнятими уявленнями, потенціал в шарі Гельмгольца при збільшенні відстані від шару потенціалвизначальних йонів знижується до потенціалу дифузного шару лінійно, а потім за експонентою.
Теорія Штерна враховує також специфічну (некулонівську) адсорбцію на поверхні розділу фаз, яка суттєвим чином може впливати на зміну потенціалу. Наприклад, якщо протийони мають однакову валентність, то товщина ПЕШ і число протийонів у дифузному шарі визначаються специфічною адсорбційною здатністю йонів, зумовленою її поляризованістю та гідратацією.
Ці властивості йонів визначаються їх справжнім радіусом або, що теж саме, розміщенням відповідних елементів у періодичній таблиці хімічних елементів.
Більша поляризовність йона повинна, зазвичай, сприяти зменшенню товщини ПЕШ, оскільки при цьому виникають додаткові адсорбційні сили між твердою фазою та індукованою поверхнею, і крім того, йон може ближче підійти до поверхні твердої фази.
Оскільки здатність йона до деформації збільшується з його розмірами і оскільки радіуси аніонів, загалом, значно більші від радіусів катіонів, поляризовність аніонів зазвичай більша від поляризовності катіонів (табл. 3.5).
Таблиця 3.5 – Поляризовність деяких йонів
-
Катіони
Поляризовність, а10-24 см3
Аніони
Поляризовність, а10-24 см3
Li+
Na+
K+
Rb+
Cs+
0,03
0,19
0,89
1,50
2,60
F–
Cl–
Br–
I–
0,96
3,60
5,00
7,60
Гідратація, як відомо, зменшується зі збільшенням радіуса йонів. Зниження гідратації йонів повинно сприяти стисненню ПЕШ, оскільки гідратована оболонка зменшує електростатичну взаємодію між протийонами і поверхнею твердої фази.
З усього вищенаведеного стає зрозумілим, чому здатність стискати ПЕШ і зменшувати дзета-потенціал зростає в ряду катіонів від Li+ до Cs+ і від Mg2+ до Ba2+, а в ряду аніонів від F– до I–.
Крім того, теорія Штерна може пояснити причини зміни знаку дзета-потенціалу при введенні в систему багатовалентних йонів, заряд яких протилежний за знаком заряду дисперсної фази. Такі багатовалентні йони втягуються в адсорбційний шар як внаслідок сильних електростатичних взаємодій, так і з-за великої здатності до адсорбції, пов’язаної з поляризованістю таких йонів. Ці йони можуть адсорбуватись в такій кількості, що не тільки нейтралізують заряд твердої поверхні, але й перезаряджають частинку.
В
Рисунок 3.29 − Зміна
падіння потенціалу ПЕШ при
перезарядці полівалентними йонами
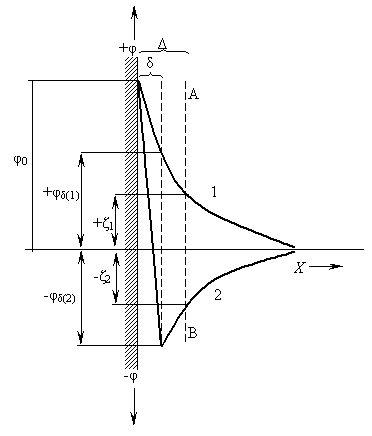
![]() -потенціали,
які мали раніше однакові заряди і
однаковий знак з
-потенціалом
(на рис. 3.29:
-потенціали,
які мали раніше однакові заряди і
однаковий знак з
-потенціалом
(на рис. 3.29:
![]() і
),
змінюють знак на протилежний (на рис.
3.29:
і
),
змінюють знак на протилежний (на рис.
3.29:
![]() і
).
При цьому, зазвичай, потенціал
залишається сталим, оскільки “чужі”
йони не здатні добудовувати кристалічну
гратку твердої фази. Таким чином,
створюються умови, коли
-
і
-потенціали
будуть мати різні знаки.
і
).
При цьому, зазвичай, потенціал
залишається сталим, оскільки “чужі”
йони не здатні добудовувати кристалічну
гратку твердої фази. Таким чином,
створюються умови, коли
-
і
-потенціали
будуть мати різні знаки.
З усього вищесказаного видно, що теорія Штерна краще відповідає експериментальним даним, ніж теорія Гуї-Чепмена, хоча й вона не позбавлена деяких недоліків.
