
- •1 Хімічна термодинаміка 4
- •2 Дисперсні системи 32
- •3 Поверхневі явища 64
- •1 Хімічна термодинаміка
- •1.1 Основи фізичної хімії. Хімічна термодинаміка
- •1.1.1 Основні поняття і терміни хімічної термодинаміки
- •1.1.2 Перший закон термодинаміки
- •1.1.3 Теплові ефекти фізико – хімічних процесів
- •1.1.3.1 Розрахунки теплових ефектів
- •1.1.4 Висновки з закону Гесса
- •1.1.5 Залежність теплового ефекту процесу від температури
- •1.2 Напрямок перебігу фізико – хімічних процесів
- •1.2.1 Другий закон термодинаміки
- •1.2.2 Ентропія
- •1.2.3 Третій постулат термодинаміки
- •1.2.4 Зміна ентропії у фізико-хімічних процесах
- •1.2.5 Вільна енергія і напрямок хімічних реакцій
- •Приклади рішення задач
- •Розв’язок
- •Відповідь: 159,9 Дж/моль·к.
- •2 Дисперсні системи
- •2.1 Класифікація дисперсних систем
- •2.1.1 Основні терміни колоїдної хімії
- •2.1.2 Класифікація дисперсних систем
- •2.1.2.1 За характером дисперсності
- •2.1.2.2 За ступенем дисперсності
- •2.1.2.3 За агрегатним станом дисперсної фази і дисперсійного середовища
- •2.1.2.4 За характером взаємодії між частинками дисперсної фази і дисперсійним середовищем
- •2.1.2.5 За характером взаємодії між самими частинками дисперсної фази
- •2.1.2.6 За формою частинок дисперсної фази (за топографічною ознакою)
- •2.1.3 Одержання і очистка дисперсних систем
- •2.1.3.1 Основні методи одержання дисперсних систем
- •2.1.3.2 Очистка колоїдних систем
- •2.2 Молекулярно-кінетичні властивості дисперсних систем
- •2.2.1 Броунівський рух
- •2.2.2 Дифузія
- •2.2.3 Осмотичний тиск
- •2.2.4 Седиментація
- •2.2.4.1 Седиментаційно-дифузійна рівновага
- •2.2.4.2 Седиментаційний аналіз
- •2.2.5 Оптичні властивості дисперсних систем
- •2.2.5.1 Розсіяння світла
- •2.2.5.2 Оптичні методи дослідження дисперсних систем
- •Контрольні питання
- •Приклади розв’язку задач
- •3.1.2 Поверхневий натяг
- •3.1.3 Класифікація поверхневих явищ
- •3.1.4 Поверхневий натяг на межі двох рідин. Взаємне розтікання рідин
- •3.1.5 Адгезія і когезія. Явища розтікання та змочування
- •3.1.5.1 Поняття про когезію та адгезію
- •3.1.5.2 Змочування поверхні твердого тіла рідиною
- •3.1.5.3 Адгезія між твердим тілом і рідиною
- •3.1.5.4 Капілярні явища
- •Контрольні питання
- •3.2 Поверхневі явища на межі тверде тіло – газ, тверде тіло – рідина, рідина – газ, рідина – рідина, тверде тіло – рідина, тверде тіло – тверде тіло
- •3.2.1 Кількісна характеристика адсорбції. Величини адсорбції
- •3.2.2 Рівняння стану адсорбції
- •3.2.3 Теплота адсорбції
- •3.2.4 Залежність адсорбції від температури та природи газу
- •3.2.5 Фізична адсорбція газів і парів на гладкій твердій поверхні. Закон Генрі
- •3.2.6 Теорія адсорбції і рівняння Ленгмюра
- •3.2.7 Ізотерма адсорбції Фрейндліха
- •3.2.8 Рівняння бет (Брунауера,Еммета,Теллера)
- •Аналогічно
- •3.2.9 Швидкість адсорбції
- •3.2.10 Хімічна адсорбція газів на твердій гладкій і пористій поверхні
- •3.2.11 Капілярна конденсація
- •Отже, при сталій температурі
- •Контрольні питання
- •3.3 Електричні явища на межі тверде тіло – рідина. Будова міцели
- •3.3.1 Електрокінетичні явища
- •3.3.2 Утворення і будова подвійного електричного шару на межі тверде тіло – рідина
- •3.3.2.1 Механізм утворення пеш
- •3.3.2.2 Термодинамічне співвідношення між поверхневим натягом і електричним потенціалом
- •3.3.2.3 Теорія будови пеш Гельмгольца-Перрена
- •3.3.2.4 Теорія будови пеш Гуї-Чепмена
- •3.3.2.5 Теорія будови пеш Штерна
- •3.3.3 Вирази для дзета-потенціалу
- •3.3.4 Вплив різних факторів на дзета-потенціал
- •3.3.4.1 Вплив індиферентних електролітів
- •3.3.4.2 Вплив неіндиферентних електролітів
- •3.3.4.3 Вплив pH-середовища
- •3.3.4.4 Вплив концентрації колоїдної системи
- •3.3.4.5 Вплив температури
- •3.3.4.6 Вплив природи дисперсійного середовища
- •3.3.5 Міцелярна теорія колоїдних розчинів
- •3.3.6 Йонна адсорбція з розчинів на твердому адсорбенті
- •3.3.6.1 Йонообмінна адсорбція
- •3.4 Стійкість дисперсних систем
- •3.4.1 Види стійкості дисперсних систем
- •3.4.2 Процеси, обумовлені агрегативною нестійкістю
- •3.4.3 Фактори стійкості дисперсних систем
- •3.4.4 Коагуляція гідрофобних золів
- •3.4.4.1 Коагуляція під дією електролітів. Правило Шульце−Гарді
- •3.4.4.2 Гетерокоагуляція. Взаємна коагуляція золів
- •3.4.5 Теорії стійкості і коагуляції
- •3.4.5.1 Адсорбційна теорія коагуляції г.Фрейндліха
- •3.4.5.2 Електростатична теорія коагуляції г.Мюллера
- •3.4.5.3 Теорія стійкості систем длфо
- •3.4.5.4. Вплив концентрації електроліту на потенціальні криві взає-модії частинок
- •3.4.6 Швидкість коагуляції
- •3.4.7 Колоїдний захист
- •Контрольні питання
- •Розв’язок
- •Розв’язок
- •3.5 Характеристика мікрогетерогенних дисперних систем План
- •Металокерамічні матеріали
- •3.5.1 Дисперсні системи з газовим дисперсійним середовищем (аерозолі)
- •3.5.2 Дисперсні системи з рідинним дисперсійним середовищем
- •3.5.2.1 Суспензії
- •3.5.2.2 Емульсії
- •3.5.2.3 Латекси
- •3.5.3 Дисперсні системи з твердим дисперсійним середовищем (тверді золі, солідозолі)
- •3.5.3.1 Дисперсні системи з твердим дисперсійним середовищем і газоподібною дисперсною фазою (тверді піни)
- •3.5.3.2 Дисперсні системи з твердим дисперсійним середовищем і рідинною дисперсною фазою (тверді емульсії)
- •3.5.3.3 Дисперсні системи з твердим дисперсійним середовищем і твердою дисперсною фазою
- •3.5.4 Композиційні матеріали (композити)
- •3.5.4.1 Металокерамічні матеріали
3.2.11 Капілярна конденсація
Явище капілярної конденсації не слід плутати з фізичною адсорбцією. Елементарна теорія капілярної конденсації не враховує специфічної дії поверхневих сил. Доказом відмінності капілярної конденсації від полімолекулярної фізичної адсорбції служить той факт, що полімолекулярна адсорбція може відбуватися на плоских поверхнях, тоді як капілярна конденсація в таких умовах неможлива.
Щоби вияснити можливість конденсації пари на поверхні рідинної плівки адсорбата в порах, слід знайти залежність тиску пари від кривизни поверхні рідини. Виникнення вигнутих менісків слід представити як результат злиття рідинних шарів, що утворюються на стінках капіляра внаслідок адсорбції парів. Зрозуміло, що виникнення вигнутих менісків можливе тільки в тому випадку, якщо утворена рідина змочує стінки капіляра. Внаслідок утворення в капілярах вигнутих менісків пари адсорбтива конденсуються при тисках, менших від тиску пари над плоскою поверхнею.
Щоби вияснити можливість конденсації пари на поверхні рідинної плівки адсорбата в порах, потрібно знайти залежність тиску пари від кривизни поверхні рідини.
Нехай фаза І, в якій лежить центр кривизни, є газоподібною, а фаза ІІ – рідинна плівка. Тоді різниця гідростатичних тисків у фазах І і ІІ дорівнює
![]() ,
,
де
![]() і
і
![]() – гідростатичні тиски в фазах І і ІІ;
– гідростатичні тиски в фазах І і ІІ;
![]() і
і
![]() – головні кривизни поверхні меніска
рідини;
– поверхневий натяг рідини.
– головні кривизни поверхні меніска
рідини;
– поверхневий натяг рідини.
Тиск пари над цією поверхнею у фазі І визначається хімічним потенціалом пари
![]() , (3.16)
, (3.16)
де ![]() – стаціонарний хімічний потенціал
пари;
– стаціонарний хімічний потенціал
пари;
– газова стала;
– термодинамічна температура;
– тиск пари.
При
рівновазі пари з рідиною у фазі ІІ
хімічні потенціали рівні:
![]() .
.
Отже, при сталій температурі
![]() .
.
З
другого боку,
![]() ,
де
,
де
![]() – мольний об’єм рідини. Звідси
– мольний об’єм рідини. Звідси
![]() , (3.17)
, (3.17)
Інтегруючи
це рівняння по тиску в межах від
(відповідає даній кривизні поверхні
(![]() )
і тиску пари) до
(відповідає плоскій поверхні рідини
)
і вважаючи
сталим, одержимо
)
і тиску пари) до
(відповідає плоскій поверхні рідини
)
і вважаючи
сталим, одержимо
 . (3.18)
. (3.18)
Маючи
на увазі, що для плоскої поверхні
![]() і
і
![]() (тобто загальний тиск в газовій фазі не
змінюється), отримаємо
(тобто загальний тиск в газовій фазі не
змінюється), отримаємо
![]() ,
,
або в логарифмічній формі
![]() . (3.19)
. (3.19)
Це рівняння Томсона (Кельвіна) дає залежність тиску над поверхнею меніску від його кривизни, показуючи, що в тонких капілярах з ростом кривизни вгнутого меніска тиск зменшується, а для випуклого – збільшується.
Для
сферичного меніска
![]() ,
а при повному змочуванні (
,
а при повному змочуванні (![]() ,
,
![]() )
)
![]() ,
де
– радіус круглого капіляра. Тому формула
Томсона для такого меніска
,
де
– радіус круглого капіляра. Тому формула
Томсона для такого меніска
![]() ,
,
де ![]() – радіус сферичного меніска.
– радіус сферичного меніска.
Для циліндричного меніска кривизна вздовж осі циліндра дорівнює нулю, тому
![]() ,
,
де ![]() – радіус циліндричного меніска.
– радіус циліндричного меніска.
Таким чином, пари над циліндричним меніском радіуса знижується менше (в числівнику експоненти немає коефіцієнта 2), ніж над сферичним меніском.
Отже,
над вигнутими менісками рідини пара
стає насиченою при
![]() або при
або при
![]() .
.
Таким чином, якщо пори адсорбента являють собою тонкі капіляри, стінки яких покриті плівкою адсорбованої рідини, що утворює вигнутий меніск, конденсація пари цієї рідини відбудеться при меншому тиску, ніж тиск насиченої пари над плоскою поверхнею при тій же температурі. Рідина, що конденсується, може при цьому повністю заповнити капіляр.
Радіус меніска, при якому починається капілярна конденсація, залежить від розмірів молекул газу (пари), що адсорбується і звичайно він буває в межах 1,0-1,5 нм.
П ориста
структура адсорбента різноманітна,
однак вважалось, що її можна змоделювати
трьома видами пор: 1) конусоподібними;
2) циліндричними з одним відкритим
кінцем; 3) циліндричними з двома відкритими
кінцями (див. рис. 3.21, а, б, в).
ориста
структура адсорбента різноманітна,
однак вважалось, що її можна змоделювати
трьома видами пор: 1) конусоподібними;
2) циліндричними з одним відкритим
кінцем; 3) циліндричними з двома відкритими
кінцями (див. рис. 3.21, а, б, в).
Конденсація в конусоподібних порах починається з пор, де утворюється сферичний меніск і де кривизна найбільша. В міру заповнення пори радіус меніска збільшується і, відповідно, зменшується кривизна, тому для подальшого заповнення пори потрібно збільшувати тиск (рис. 3.21, а). Процес десорбції протікає в оберненому напрямі і описується цією самою кривою.
В циліндричних порах з одним відкритим кінцем конденсація починається також з дна пори, де кривизна сферична і тому найбільша (рис. 3.21, б). Тут при капілярній конденсації і не змінюються, ізотерма капілярної конденсації буде вертикальною. Оскільки пора має циліндричну форму, то вона заповнюється повністю при певному радіусі меніска, який відповідає певному тиску пари. Капілярна конденсація в цих порах також відбувається зворотно.
Я
Рисунок
3.22 − Схема пори, утвореної правильним
упакуванням сферичних частинок рівних
розмірів з числом контактів 6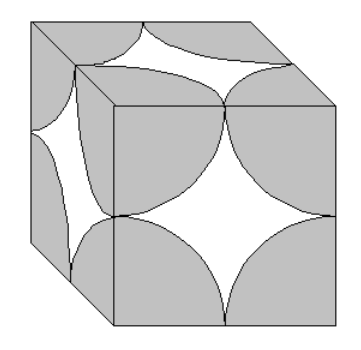
![]() .
Десорбція може початися тільки при
тиску, що відповідає радіусам кривизни
цих менісків. Таким чином, випорожнення
капіляра відбувається при меншому
тиску, ніж його заповнення. Цим пояснюється
поява петлі капілярно-конденсаційного
гістерезису. Капілярно-конденсаційний
гістерезис часто зумовлений також і
кінетичними причинами. Наприклад, він
може бути пов’язаний з проявами
гістерезису змочування. Суха поверхня
капіляра з адсорбованим повітрям гірше
змочується водою і тому для заповнення
пор потрібний тиск пари дещо більший
від рівноважного. При десорбції
випаровування відбувається з пор,
повністю змочених рідиною. Завдяки
відсутності адсорбованого повітря кут
змочування буде меншим і відповідно
меншим буде тиск пари при тому ж ступені
заповнення пор.
.
Десорбція може початися тільки при
тиску, що відповідає радіусам кривизни
цих менісків. Таким чином, випорожнення
капіляра відбувається при меншому
тиску, ніж його заповнення. Цим пояснюється
поява петлі капілярно-конденсаційного
гістерезису. Капілярно-конденсаційний
гістерезис часто зумовлений також і
кінетичними причинами. Наприклад, він
може бути пов’язаний з проявами
гістерезису змочування. Суха поверхня
капіляра з адсорбованим повітрям гірше
змочується водою і тому для заповнення
пор потрібний тиск пари дещо більший
від рівноважного. При десорбції
випаровування відбувається з пор,
повністю змочених рідиною. Завдяки
відсутності адсорбованого повітря кут
змочування буде меншим і відповідно
меншим буде тиск пари при тому ж ступені
заповнення пор.
В
адсорбентах глобулярної структури пори
мають складну форму зі звуженнями в
місцях контактів глобул, розширеннями
в середній частині і горлами (вікнами),
які ведуть від однієї “елементарної
пори” до іншої. На рис. 3.22 показана
схема такої пори при кількості контактів
однакових глобул 6. В конусоподібних
частинах пори капілярна конденсація
починається зворотно, як у випадку
конусоподібних пор (рис.3.21, а). Однак,
пересуваючись до горла такої пори,
меніски при їх злитті одні з одним
утворюють в цих горлах меніски
кільцеподібної (приблизно циліндричної)
форми. Ці горла разом з більш широкими
просторами між глобулами при тиску
,
близькому до
![]() меніска в горлі, заповнюються стрибком
подібно до циліндричної пори з відкритими
двома кінцями. При десорбції в горлах
пор між глобулами утворюються меніски
сферичної форми, котрі прориваються
лише при тиску
меніска в горлі, заповнюються стрибком
подібно до циліндричної пори з відкритими
двома кінцями. При десорбції в горлах
пор між глобулами утворюються меніски
сферичної форми, котрі прориваються
лише при тиску
![]() .
Це призводить до петлі гістерезису
(див. рис. 3.21, в).
.
Це призводить до петлі гістерезису
(див. рис. 3.21, в).
В реальних умовах капілярна конденсація накладається на адсорбцію. Полімолекулярна адсорбція призводить до звуження горла пор так, що навіть у випадку дуже пухких упакувань твердих частинок досить малих розмірів спостерігається капілярно-конденсаційний гістерезис.
Нарешті слід зазначити, що теплота капілярної конденсації більша від теплоти звичайної конденсації.
Капілярна конденсація парів води в капілярах ґрунтів і гірських порід відіграє суттєву роль у водному режимі ґрунтів і глинистих порід. Капілярна конденсація широко використовується в промисловості для вловлювання парів рідин мікродисперсними адсорбентами.
