
- •1 Хімічна термодинаміка 4
- •2 Дисперсні системи 32
- •3 Поверхневі явища 64
- •1 Хімічна термодинаміка
- •1.1 Основи фізичної хімії. Хімічна термодинаміка
- •1.1.1 Основні поняття і терміни хімічної термодинаміки
- •1.1.2 Перший закон термодинаміки
- •1.1.3 Теплові ефекти фізико – хімічних процесів
- •1.1.3.1 Розрахунки теплових ефектів
- •1.1.4 Висновки з закону Гесса
- •1.1.5 Залежність теплового ефекту процесу від температури
- •1.2 Напрямок перебігу фізико – хімічних процесів
- •1.2.1 Другий закон термодинаміки
- •1.2.2 Ентропія
- •1.2.3 Третій постулат термодинаміки
- •1.2.4 Зміна ентропії у фізико-хімічних процесах
- •1.2.5 Вільна енергія і напрямок хімічних реакцій
- •Приклади рішення задач
- •Розв’язок
- •Відповідь: 159,9 Дж/моль·к.
- •2 Дисперсні системи
- •2.1 Класифікація дисперсних систем
- •2.1.1 Основні терміни колоїдної хімії
- •2.1.2 Класифікація дисперсних систем
- •2.1.2.1 За характером дисперсності
- •2.1.2.2 За ступенем дисперсності
- •2.1.2.3 За агрегатним станом дисперсної фази і дисперсійного середовища
- •2.1.2.4 За характером взаємодії між частинками дисперсної фази і дисперсійним середовищем
- •2.1.2.5 За характером взаємодії між самими частинками дисперсної фази
- •2.1.2.6 За формою частинок дисперсної фази (за топографічною ознакою)
- •2.1.3 Одержання і очистка дисперсних систем
- •2.1.3.1 Основні методи одержання дисперсних систем
- •2.1.3.2 Очистка колоїдних систем
- •2.2 Молекулярно-кінетичні властивості дисперсних систем
- •2.2.1 Броунівський рух
- •2.2.2 Дифузія
- •2.2.3 Осмотичний тиск
- •2.2.4 Седиментація
- •2.2.4.1 Седиментаційно-дифузійна рівновага
- •2.2.4.2 Седиментаційний аналіз
- •2.2.5 Оптичні властивості дисперсних систем
- •2.2.5.1 Розсіяння світла
- •2.2.5.2 Оптичні методи дослідження дисперсних систем
- •Контрольні питання
- •Приклади розв’язку задач
- •3.1.2 Поверхневий натяг
- •3.1.3 Класифікація поверхневих явищ
- •3.1.4 Поверхневий натяг на межі двох рідин. Взаємне розтікання рідин
- •3.1.5 Адгезія і когезія. Явища розтікання та змочування
- •3.1.5.1 Поняття про когезію та адгезію
- •3.1.5.2 Змочування поверхні твердого тіла рідиною
- •3.1.5.3 Адгезія між твердим тілом і рідиною
- •3.1.5.4 Капілярні явища
- •Контрольні питання
- •3.2 Поверхневі явища на межі тверде тіло – газ, тверде тіло – рідина, рідина – газ, рідина – рідина, тверде тіло – рідина, тверде тіло – тверде тіло
- •3.2.1 Кількісна характеристика адсорбції. Величини адсорбції
- •3.2.2 Рівняння стану адсорбції
- •3.2.3 Теплота адсорбції
- •3.2.4 Залежність адсорбції від температури та природи газу
- •3.2.5 Фізична адсорбція газів і парів на гладкій твердій поверхні. Закон Генрі
- •3.2.6 Теорія адсорбції і рівняння Ленгмюра
- •3.2.7 Ізотерма адсорбції Фрейндліха
- •3.2.8 Рівняння бет (Брунауера,Еммета,Теллера)
- •Аналогічно
- •3.2.9 Швидкість адсорбції
- •3.2.10 Хімічна адсорбція газів на твердій гладкій і пористій поверхні
- •3.2.11 Капілярна конденсація
- •Отже, при сталій температурі
- •Контрольні питання
- •3.3 Електричні явища на межі тверде тіло – рідина. Будова міцели
- •3.3.1 Електрокінетичні явища
- •3.3.2 Утворення і будова подвійного електричного шару на межі тверде тіло – рідина
- •3.3.2.1 Механізм утворення пеш
- •3.3.2.2 Термодинамічне співвідношення між поверхневим натягом і електричним потенціалом
- •3.3.2.3 Теорія будови пеш Гельмгольца-Перрена
- •3.3.2.4 Теорія будови пеш Гуї-Чепмена
- •3.3.2.5 Теорія будови пеш Штерна
- •3.3.3 Вирази для дзета-потенціалу
- •3.3.4 Вплив різних факторів на дзета-потенціал
- •3.3.4.1 Вплив індиферентних електролітів
- •3.3.4.2 Вплив неіндиферентних електролітів
- •3.3.4.3 Вплив pH-середовища
- •3.3.4.4 Вплив концентрації колоїдної системи
- •3.3.4.5 Вплив температури
- •3.3.4.6 Вплив природи дисперсійного середовища
- •3.3.5 Міцелярна теорія колоїдних розчинів
- •3.3.6 Йонна адсорбція з розчинів на твердому адсорбенті
- •3.3.6.1 Йонообмінна адсорбція
- •3.4 Стійкість дисперсних систем
- •3.4.1 Види стійкості дисперсних систем
- •3.4.2 Процеси, обумовлені агрегативною нестійкістю
- •3.4.3 Фактори стійкості дисперсних систем
- •3.4.4 Коагуляція гідрофобних золів
- •3.4.4.1 Коагуляція під дією електролітів. Правило Шульце−Гарді
- •3.4.4.2 Гетерокоагуляція. Взаємна коагуляція золів
- •3.4.5 Теорії стійкості і коагуляції
- •3.4.5.1 Адсорбційна теорія коагуляції г.Фрейндліха
- •3.4.5.2 Електростатична теорія коагуляції г.Мюллера
- •3.4.5.3 Теорія стійкості систем длфо
- •3.4.5.4. Вплив концентрації електроліту на потенціальні криві взає-модії частинок
- •3.4.6 Швидкість коагуляції
- •3.4.7 Колоїдний захист
- •Контрольні питання
- •Розв’язок
- •Розв’язок
- •3.5 Характеристика мікрогетерогенних дисперних систем План
- •Металокерамічні матеріали
- •3.5.1 Дисперсні системи з газовим дисперсійним середовищем (аерозолі)
- •3.5.2 Дисперсні системи з рідинним дисперсійним середовищем
- •3.5.2.1 Суспензії
- •3.5.2.2 Емульсії
- •3.5.2.3 Латекси
- •3.5.3 Дисперсні системи з твердим дисперсійним середовищем (тверді золі, солідозолі)
- •3.5.3.1 Дисперсні системи з твердим дисперсійним середовищем і газоподібною дисперсною фазою (тверді піни)
- •3.5.3.2 Дисперсні системи з твердим дисперсійним середовищем і рідинною дисперсною фазою (тверді емульсії)
- •3.5.3.3 Дисперсні системи з твердим дисперсійним середовищем і твердою дисперсною фазою
- •3.5.4 Композиційні матеріали (композити)
- •3.5.4.1 Металокерамічні матеріали
3.2.10 Хімічна адсорбція газів на твердій гладкій і пористій поверхні
Поряд з типовою фізичною адсорбцією часто на практиці відбувається хімічна адсорбція, або хемосорбція, яка здійснюється за рахунок хімічних сил. Слід зазначити, що чіткої межі між цими двома типами адсорбції не існує, хоча в граничних випадках вони розрізняються легко. Адсорбція одного і того ж адсорбтива на одному і тому ж адсорбенті в одних умовах може бути фізичною, в інших – хімічною. Крім того, фізична адсорбція може протікати як поверх хемосорбованого шару, так і паралельно з хемосорбцією. Наприклад, інфрачервоні спектри оксиду вуглецю (IV), адсорбованого на оксиді алюмінію, показують присутність на поверхні адсорбента як фізично адсорбованих, так і хемосорбованих молекул СО2.
Фізична і хімічна адсорбція розрізняються за такими ознаками. Фізична адсорбція є зворотною і малоспецифічною. Диференціальна теплота фізичної адсорбції зазвичай всього 10-40 кДж/моль і співрозмірна з теплотою конденсації парів. Теплота хемосорбції може досягати 400-800 кДж/моль, тобто має порядок теплот хімічних реакцій. Хімічна адсорбція зазвичай незворотна. При фізичній адсорбції рівновага наступає дуже швидко і зазвичай починає відігравати важливу роль, лише коли температура газу понижується нижче критичної, тобто коли газ знаходиться у вигляді пари. Хемосорбція може бути як швидкою, так і повільною і може протікати при температурі і вищій, і нижчій від критичної температури адсорбтива. Підвищення температури зменшує фізичну адсорбцію і, навпаки, сприяє хемосорбції. Температурний коефіцієнт при хемосорбції має той же порядок, що й при хімічних процесах, оскільки енергія активації хемосорбції досить велика.
В останньому випадку це пояснюється тим, що хемосорбція є хімічним процесом, який звичайно вимагає значної енергії активації (40-120 кДжд/моль). Саме тому хемосорбція, як правило, є активованою адсорбцією.
Оскільки хімічну адсорбцію зумовлюють хімічні сили, десорбція протікає важко і майже завжди замість адсорбованої речовини десорбується інша. По-суті, десорбція здійснюється тут не за рахунок видалення молекули з поверхні адсорбента, а в результаті розкладу утвореної при хемосорбції поверхневої сполуки. Хемосорбція, як і хімічна реакція, є специфічною, тобто з адсорбентом можуть взаємодіяти тільки певні адсорбтиви. Суттєвим є те, що енергія активації зростає з підвищенням ступеня покриття поверхні адсорбента хемосорбованими молекулами. Це можна пояснити лише існуванням активних центрів з різними енергіями активації.
Хемосорбція нерідко протікає досить повільно зі швидкістю, що визначається наявністю певного активаційного бар’єру. Фактично процес хемосорбції може складатися з двох стадій. Спочатку відбувається фізична адсорбція газу, а потім він вступає в повільну хімічну реакцію з поверхнею твердого тіла. При низьких температурах швидкість хемосорбції може бути такою малою, що практично спостерігається лише фізична адсорбція. При високих температурах фізична адсорбція є майже непомітною (внаслідок низької енергії адсорбції) і відбувається лише хемосорбція.
Я
Рисунок
3.20 − Ізобара адсорбції водню
на
нікелі в області переходу від фізичної
адсорбції до хемосорбції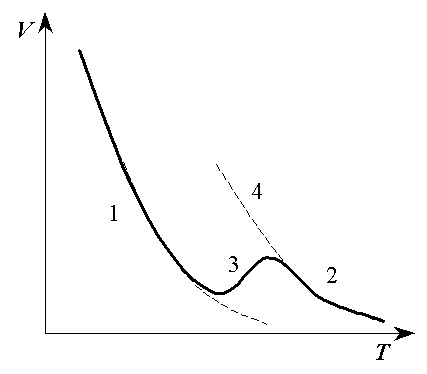
Іншим типовим прикладом є адсорбція кисню на вугіллі. При температурах –150…–200С кисень адсорбується зворотно завдяки фізичним взаємодіям; диференціальна теплота адсорбції при цьому дорівнює 15,5 кДж/моль. При кімнатній температурі частина кисню адсорбується уже незворотно, а диференціальна теплота адсорбції, яка становить близько 290 кДж/моль, вказує на протікання хімічної реакції. Причиною цього є те, що на поверхні вуглецю, очевидно, атоми вуглецю мають вільні валентності. Завдяки ненасиченості атомів вуглецю на поверхні вугілля може адсорбуватися кисень. Процес можна представити схемою
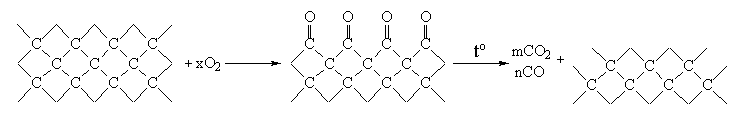
При спробі адсорбувати адсорбат нагріванням з поверхні видаляється не кисень, а оксиди вуглецю. Це вказує на те, що зв’язок між атомами кисню і вуглецю міцніший, ніж зв’язок між атомами вуглецю.
Утворені при хемосорбції мономолекулярні шари нових сполук (“поверхневі сполуки” за термінологією Шилова) не можна не розглядати як нову фазу, нову речовину.
Як фізична, так і хімічна адсорбція відіграють велику роль в гетерогенному каталізі, оскільки на поверхні каталізатора молекули адсорбата реагують між собою набагато швидше.
Пористі тіла – це тверді тіла, всередині яких є пори, що зумовлюють наявність внутрішньої міжфазної поверхні. Пори можуть бути заповнені газом або рідиною. Згідно з класифікацією дисперсних систем за агрегатним станом фаз пористі тіла діляться на дисперсні системи з твердим дисперсійним середовищем і газоподібною (так звані тверді піни) або рідинною дисперсною фазою (так звані тверді емульсії). До таких систем належать затверділа вулканічна лава – пемза, кокс, активоване вугілля, торф, деревина, глина, грунт, картон, папір, пористі полімери, пористі адсорбенти.
Пористі тіла за своїми механічними властивостями можуть бути крихкими й еластичними.
За розмірами пор пористі тіла поділяють на макропористі, перехіднопористі та мікропористі.
Макропористі тіла мають пори з радіусом більшим за 100-200 нм. Питома поверхня цих тіл знаходиться в межах 0,5-2 м2/г. Такі пори в порівнянні з розмірами молекул адсорбата “виглядають” рівними поверхнями і тому для макропористих тіл можна застосовувати узагальнену теорію адсорбції Ленгмюра, тобто теорію БЕТ.
Перехіднопористі тіла мають розміри пор від 2,0 до 100-200 нм. Їх питома поверхня становить від 20 до 500 м2/г. На стінках цих пор при малих тисках відбувається полімолекулярна адсорбція парів, яка зі збільшенням тиску завершується капілярною конденсацією. Із промислових адсорбентів і каталізаторів до перехіднопористих можна віднести силікагель, алюмогель, алюмосилікагелі.
Мікропористі тіла володіють порами, співрозмірними з розмірами молекул адсорбата. Радіуси пор лежать в межах від 0,5 до 1,5-2 нм. Питома поверхня таких тіл становить 500-1000 м2/г і більше. До мікропористих тіл можна застосовувати теорію капілярної конденсації, що ми й будемо робити в цьому розділі. До мікропористих адсорбентів належать цеоліти та деякі марки активованого вугілля.
