- •1 Хімічна термодинаміка 4
- •2 Дисперсні системи 32
- •3 Поверхневі явища 64
- •1 Хімічна термодинаміка
- •1.1 Основи фізичної хімії. Хімічна термодинаміка
- •1.1.1 Основні поняття і терміни хімічної термодинаміки
- •1.1.2 Перший закон термодинаміки
- •1.1.3 Теплові ефекти фізико – хімічних процесів
- •1.1.3.1 Розрахунки теплових ефектів
- •1.1.4 Висновки з закону Гесса
- •1.1.5 Залежність теплового ефекту процесу від температури
- •1.2 Напрямок перебігу фізико – хімічних процесів
- •1.2.1 Другий закон термодинаміки
- •1.2.2 Ентропія
- •1.2.3 Третій постулат термодинаміки
- •1.2.4 Зміна ентропії у фізико-хімічних процесах
- •1.2.5 Вільна енергія і напрямок хімічних реакцій
- •Приклади рішення задач
- •Розв’язок
- •Відповідь: 159,9 Дж/моль·к.
- •2 Дисперсні системи
- •2.1 Класифікація дисперсних систем
- •2.1.1 Основні терміни колоїдної хімії
- •2.1.2 Класифікація дисперсних систем
- •2.1.2.1 За характером дисперсності
- •2.1.2.2 За ступенем дисперсності
- •2.1.2.3 За агрегатним станом дисперсної фази і дисперсійного середовища
- •2.1.2.4 За характером взаємодії між частинками дисперсної фази і дисперсійним середовищем
- •2.1.2.5 За характером взаємодії між самими частинками дисперсної фази
- •2.1.2.6 За формою частинок дисперсної фази (за топографічною ознакою)
- •2.1.3 Одержання і очистка дисперсних систем
- •2.1.3.1 Основні методи одержання дисперсних систем
- •2.1.3.2 Очистка колоїдних систем
- •2.2 Молекулярно-кінетичні властивості дисперсних систем
- •2.2.1 Броунівський рух
- •2.2.2 Дифузія
- •2.2.3 Осмотичний тиск
- •2.2.4 Седиментація
- •2.2.4.1 Седиментаційно-дифузійна рівновага
- •2.2.4.2 Седиментаційний аналіз
- •2.2.5 Оптичні властивості дисперсних систем
- •2.2.5.1 Розсіяння світла
- •2.2.5.2 Оптичні методи дослідження дисперсних систем
- •Контрольні питання
- •Приклади розв’язку задач
- •3.1.2 Поверхневий натяг
- •3.1.3 Класифікація поверхневих явищ
- •3.1.4 Поверхневий натяг на межі двох рідин. Взаємне розтікання рідин
- •3.1.5 Адгезія і когезія. Явища розтікання та змочування
- •3.1.5.1 Поняття про когезію та адгезію
- •3.1.5.2 Змочування поверхні твердого тіла рідиною
- •3.1.5.3 Адгезія між твердим тілом і рідиною
- •3.1.5.4 Капілярні явища
- •Контрольні питання
- •3.2 Поверхневі явища на межі тверде тіло – газ, тверде тіло – рідина, рідина – газ, рідина – рідина, тверде тіло – рідина, тверде тіло – тверде тіло
- •3.2.1 Кількісна характеристика адсорбції. Величини адсорбції
- •3.2.2 Рівняння стану адсорбції
- •3.2.3 Теплота адсорбції
- •3.2.4 Залежність адсорбції від температури та природи газу
- •3.2.5 Фізична адсорбція газів і парів на гладкій твердій поверхні. Закон Генрі
- •3.2.6 Теорія адсорбції і рівняння Ленгмюра
- •3.2.7 Ізотерма адсорбції Фрейндліха
- •3.2.8 Рівняння бет (Брунауера,Еммета,Теллера)
- •Аналогічно
- •3.2.9 Швидкість адсорбції
- •3.2.10 Хімічна адсорбція газів на твердій гладкій і пористій поверхні
- •3.2.11 Капілярна конденсація
- •Отже, при сталій температурі
- •Контрольні питання
- •3.3 Електричні явища на межі тверде тіло – рідина. Будова міцели
- •3.3.1 Електрокінетичні явища
- •3.3.2 Утворення і будова подвійного електричного шару на межі тверде тіло – рідина
- •3.3.2.1 Механізм утворення пеш
- •3.3.2.2 Термодинамічне співвідношення між поверхневим натягом і електричним потенціалом
- •3.3.2.3 Теорія будови пеш Гельмгольца-Перрена
- •3.3.2.4 Теорія будови пеш Гуї-Чепмена
- •3.3.2.5 Теорія будови пеш Штерна
- •3.3.3 Вирази для дзета-потенціалу
- •3.3.4 Вплив різних факторів на дзета-потенціал
- •3.3.4.1 Вплив індиферентних електролітів
- •3.3.4.2 Вплив неіндиферентних електролітів
- •3.3.4.3 Вплив pH-середовища
- •3.3.4.4 Вплив концентрації колоїдної системи
- •3.3.4.5 Вплив температури
- •3.3.4.6 Вплив природи дисперсійного середовища
- •3.3.5 Міцелярна теорія колоїдних розчинів
- •3.3.6 Йонна адсорбція з розчинів на твердому адсорбенті
- •3.3.6.1 Йонообмінна адсорбція
- •3.4 Стійкість дисперсних систем
- •3.4.1 Види стійкості дисперсних систем
- •3.4.2 Процеси, обумовлені агрегативною нестійкістю
- •3.4.3 Фактори стійкості дисперсних систем
- •3.4.4 Коагуляція гідрофобних золів
- •3.4.4.1 Коагуляція під дією електролітів. Правило Шульце−Гарді
- •3.4.4.2 Гетерокоагуляція. Взаємна коагуляція золів
- •3.4.5 Теорії стійкості і коагуляції
- •3.4.5.1 Адсорбційна теорія коагуляції г.Фрейндліха
- •3.4.5.2 Електростатична теорія коагуляції г.Мюллера
- •3.4.5.3 Теорія стійкості систем длфо
- •3.4.5.4. Вплив концентрації електроліту на потенціальні криві взає-модії частинок
- •3.4.6 Швидкість коагуляції
- •3.4.7 Колоїдний захист
- •Контрольні питання
- •Розв’язок
- •Розв’язок
- •3.5 Характеристика мікрогетерогенних дисперних систем План
- •Металокерамічні матеріали
- •3.5.1 Дисперсні системи з газовим дисперсійним середовищем (аерозолі)
- •3.5.2 Дисперсні системи з рідинним дисперсійним середовищем
- •3.5.2.1 Суспензії
- •3.5.2.2 Емульсії
- •3.5.2.3 Латекси
- •3.5.3 Дисперсні системи з твердим дисперсійним середовищем (тверді золі, солідозолі)
- •3.5.3.1 Дисперсні системи з твердим дисперсійним середовищем і газоподібною дисперсною фазою (тверді піни)
- •3.5.3.2 Дисперсні системи з твердим дисперсійним середовищем і рідинною дисперсною фазою (тверді емульсії)
- •3.5.3.3 Дисперсні системи з твердим дисперсійним середовищем і твердою дисперсною фазою
- •3.5.4 Композиційні матеріали (композити)
- •3.5.4.1 Металокерамічні матеріали
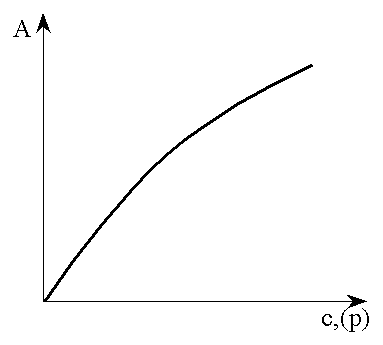
3.2.7 Ізотерма адсорбції Фрейндліха
Задовго до робіт Ленгмюра Фрейндліх експериментально знайшов залежність величини адсорбції від концентрації чи тиску:
![]() і
і
![]() ,
,
де
– рівноважний тиск;
– рівноважна концентрація;
![]() – сталі, які знаходять експериментально.
– сталі, які знаходять експериментально.
Часто адсорбцію виражають відношенням молів адсорбтива до маси адсорбента:
![]() .
.
Ізотерма адсорбції Фрейндліха має вигляд кривої і представлена на рис.3.15.
Вираз рівняння Фрейндліха через рівноважну концентрацію придатний як для адсорбції газів, так і для адсорбції розчинів.
Рівняння ізотерми адсорбції Фрейндліха можна вивести, якщо прийняти, що адсорбція не обмежується мономолекулярним шаром і кількість адсорбованої речовини необмежено зростає із збільшенням тиску чи концентрації. Наступним припущенням було, що поверхня адсорбента неоднорідна і що адсорбція на кожному із типів активних центрів підпорядковується рівнянню Ленгмюра. Крім того, Фрейндліх припускав, що між адсорбованими молекулами існує взаємодія.
Сталі
![]() і
і
![]() коливаються в широких межах. Їх фізичний
зміст стає зрозумілим, якщо прийняти
коливаються в широких межах. Їх фізичний
зміст стає зрозумілим, якщо прийняти
![]() або
або
![]() ,
тоді
і
являють собою величину адсорбції при
рівноважних тиску 1 Па або концентрації
1 моль/дм3.
Показники
,
тоді
і
являють собою величину адсорбції при
рівноважних тиску 1 Па або концентрації
1 моль/дм3.
Показники
![]() і
і
![]() є правильними дробами і характеризують
ступінь наближення ізотерми до прямої,
тому з підвищенням температури сталі
і
повинні зменшуватися, а
і
збільшуватися. При
є правильними дробами і характеризують
ступінь наближення ізотерми до прямої,
тому з підвищенням температури сталі
і
повинні зменшуватися, а
і
збільшуватися. При
![]() і
і
![]() рівняння Фрейндліха перетворюється в
рівняння Генрі. Горизонтальна прямолінійна
ділянка ізотерми, що відповідає високим
тискам або концентраціям (
в рівнянні Ленгмюра), може бути одержана
тільки при
рівняння Фрейндліха перетворюється в
рівняння Генрі. Горизонтальна прямолінійна
ділянка ізотерми, що відповідає високим
тискам або концентраціям (
в рівнянні Ленгмюра), може бути одержана
тільки при
![]() і
і
![]() .
Таким чином, показники
і
по
суті повинні бути самі функціями тиску
чи концентрації. А оскільки
і
приймаються сталими в межах 0,2–1,0 для
адсорбції із газового середовища і
може приймати значення 0,1–0,5 для адсорбції
із розчинів, рівняння Фрейндліха придатне
тільки для інтервалу середніх тисків
або концентрацій.
.
Таким чином, показники
і
по
суті повинні бути самі функціями тиску
чи концентрації. А оскільки
і
приймаються сталими в межах 0,2–1,0 для
адсорбції із газового середовища і
може приймати значення 0,1–0,5 для адсорбції
із розчинів, рівняння Фрейндліха придатне
тільки для інтервалу середніх тисків
або концентрацій.
Для практичного використання рівняння Фрейндліха логарифмують і одержують рівняння прямої, представленої на рис. 3.16:
![]() ,
,
![]() .
.
Рисунок 3.15 − Ізотерма адсорбції Фрейндліха |
Рисунок 3.16 − Логарифмічна форма ізотерми адсорбції Фрейндліха |
Точка
перетину прямої з лінією ординат дає
значення
![]() або
або
![]() ,
тангенс кута нахилу
до осі абсцис дає значення
чи
.
,
тангенс кута нахилу
до осі абсцис дає значення
чи
.
Недоліком теорії адсорбції Фрейндліха є те, що вона незадовільно пояснює дані фізичної адсорбції. Наприклад, було знайдено, що при уявному насиченні поверхні адсорбованою речовиною виявилась покритою тільки мала частка загальної площі адсорбента. Крім того, гранична адсорбція не залишається сталою, а збільшується при зниженні температури.
3.2.8 Рівняння бет (Брунауера,Еммета,Теллера)
Слід зазначити, що перші спроби одержати рівняння ізотерми полімолекулярної адсорбції були зроблені ще Ленгмюром. Сучасна ж форма рівняння полімолекулярної адсорбції – основного рівняння узагальненої теорії Ленгмюра – була запропонована пізніше Брунауером, Емметтом і Теллером (так звана теорія БЕТ).
1. На поверхні адсорбента є певне число рівноцінних в енергетичному відношенні активних центрів.
2. Взаємодія сусідніх адсорбованих шарів, першого і останнього, відсутня.
3. Кожна адсорбована молекула нижнього шару являє собою можливий активний центр для адсорбції молекул верхнього адсорбційного шару.
4. Молекули в другому, третьому й наступних шарах ведуть себе як молекули рідини.
Відомо,
що при значному тиску газ переходить в
пароподібний стан, а останній при
досягненні тиску, що дорівнює тискові
насичення
![]() ,
конденсується. При цьому
,
конденсується. При цьому
![]() і адсорбція парів рідини, що змочує
поверхню адсорбента, стає нескінченно
великою. Отже, якщо в області тисків,
далеких від насичення, ріст адсорбції
сповільнюється, то з подальшим підвищенням
тиску і наближенням
до
адсорбція починає зростати і, врешті-решт,
досягає значної величини. Адсорбційний
шар при цьому потовщується, адсорбція
стає полімолекулярною. При досягненні
наступає об’ємна конденсація.
і адсорбція парів рідини, що змочує
поверхню адсорбента, стає нескінченно
великою. Отже, якщо в області тисків,
далеких від насичення, ріст адсорбції
сповільнюється, то з подальшим підвищенням
тиску і наближенням
до
адсорбція починає зростати і, врешті-решт,
досягає значної величини. Адсорбційний
шар при цьому потовщується, адсорбція
стає полімолекулярною. При досягненні
наступає об’ємна конденсація.
П ри
виводі рівняння адсорбції БЕТ приймемо,
що при адсорбції парів адсорбовані на
уже зайнятих місцях молекули не покидають
їх негайно, але утворюються кратні
адсорбційні шари, подібні до картини,
зображеної на рис. 3.17. В міру наближення
до
число вільних місць
ри
виводі рівняння адсорбції БЕТ приймемо,
що при адсорбції парів адсорбовані на
уже зайнятих місцях молекули не покидають
їх негайно, але утворюються кратні
адсорбційні шари, подібні до картини,
зображеної на рис. 3.17. В міру наближення
до
число вільних місць
![]() скорочується, число місць, зайнятих
одношаровими комплексами
скорочується, число місць, зайнятих
одношаровими комплексами
![]() спочатку зростає, а потім за рахунок
утворення двошарових комплексів
спочатку зростає, а потім за рахунок
утворення двошарових комплексів
![]() спадає.
спадає.
Розглянемо полімолекулярну адсорбцію як серію квазіхімічних реакцій утворення двошарових і кратношарових комплексів:
-

 пара
пара+
поверхня адсорбента
одношарові комплекси
пара
+
одношарові комплекси
двошарові комплекси
і т.д.
Якщо – частки вільної поверхні, а , і т.д. – частки поверхні, зайняті одношаровими, двошаровими і т.д. комплексами, то загальна величина адсорбції з урахуванням кратності кожного комплексу буде дорівнювати
![]() , (3.7)
, (3.7)
а сталі рівноваги відповідних процесів будуть виражатися так:
![]() ,
,
![]() ,
,
![]() і т.д. (3.8)
і т.д. (3.8)
У
зв’язку з тим, що взаємодія адсорбента
дуже залежить від відстані молекул
адсорбата від поверхні адсорбента та
значно зменшується зі збільшенням
сталих
і
![]() ,
хоч і не дорівнюють одна одній, але
різниця між ними значно менша від різниці
між
і
.
Тому для наближеного опису полімолекулярної
адсорбції можна прийняти
,
хоч і не дорівнюють одна одній, але
різниця між ними значно менша від різниці
між
і
.
Тому для наближеного опису полімолекулярної
адсорбції можна прийняти
![]() ,
,
де ![]() – стала рівноваги між насиченою парою
і рідиною, яка +дорівнює
– стала рівноваги між насиченою парою
і рідиною, яка +дорівнює
![]() .
.
В цьому випадку із рівняння (3.8) випливає
![]() ;
;
![]() ;
;
![]() і т.д.
і т.д.
Підставляючи ці вирази в рівняння (3.6), отримаємо
![]() . (3.9)
. (3.9)
Сума часток заповнення
![]() . (3.10)
. (3.10)
Оскільки вираз у квадратних дужках є спадною геометричною прогресією, то сума її членів дорівнює
![]() . (3.11)
. (3.11)
З
другого боку, ряд, вміщений у квадратні
дужки рівняння (3.10), являє собою похідну
ряду по
![]() ,
тому
,
тому
![]() . (3.12)
. (3.12)
Підставивши рівняння (3.11) в рівняння (3.8), отримаємо
![]() . (3.13)
. (3.13)
З другого боку з рівнянь (3.9) і (3.11) випливає
 .
.
Підставивши цей вираз у рівняння (3.12), отримаємо
![]() . (3.14)
. (3.14)
Прийнявши
![]() та позначивши
та позначивши
![]() ,
отримаємо кінцевий вираз рівняння
полімолекулярної адсорбції БЕТ
,
отримаємо кінцевий вираз рівняння
полімолекулярної адсорбції БЕТ
![]() . (3.15)
. (3.15)
Прийнявши
![]() (приведений або відносний тиск пари)
будемо мати
(приведений або відносний тиск пари)
будемо мати
![]() .
.
Подібно до сталої рівноваги для хімічних реакцій, стала адсорбційної рівноваги пов’язана з енергією Гіббса рівнянням
![]() .
.
Потенціюючи це рівняння, отримаємо
![]() ,
,
де – так званий ентропійний множник;
![]() .
.