
- •1 Хімічна термодинаміка 4
- •2 Дисперсні системи 32
- •3 Поверхневі явища 64
- •1 Хімічна термодинаміка
- •1.1 Основи фізичної хімії. Хімічна термодинаміка
- •1.1.1 Основні поняття і терміни хімічної термодинаміки
- •1.1.2 Перший закон термодинаміки
- •1.1.3 Теплові ефекти фізико – хімічних процесів
- •1.1.3.1 Розрахунки теплових ефектів
- •1.1.4 Висновки з закону Гесса
- •1.1.5 Залежність теплового ефекту процесу від температури
- •1.2 Напрямок перебігу фізико – хімічних процесів
- •1.2.1 Другий закон термодинаміки
- •1.2.2 Ентропія
- •1.2.3 Третій постулат термодинаміки
- •1.2.4 Зміна ентропії у фізико-хімічних процесах
- •1.2.5 Вільна енергія і напрямок хімічних реакцій
- •Приклади рішення задач
- •Розв’язок
- •Відповідь: 159,9 Дж/моль·к.
- •2 Дисперсні системи
- •2.1 Класифікація дисперсних систем
- •2.1.1 Основні терміни колоїдної хімії
- •2.1.2 Класифікація дисперсних систем
- •2.1.2.1 За характером дисперсності
- •2.1.2.2 За ступенем дисперсності
- •2.1.2.3 За агрегатним станом дисперсної фази і дисперсійного середовища
- •2.1.2.4 За характером взаємодії між частинками дисперсної фази і дисперсійним середовищем
- •2.1.2.5 За характером взаємодії між самими частинками дисперсної фази
- •2.1.2.6 За формою частинок дисперсної фази (за топографічною ознакою)
- •2.1.3 Одержання і очистка дисперсних систем
- •2.1.3.1 Основні методи одержання дисперсних систем
- •2.1.3.2 Очистка колоїдних систем
- •2.2 Молекулярно-кінетичні властивості дисперсних систем
- •2.2.1 Броунівський рух
- •2.2.2 Дифузія
- •2.2.3 Осмотичний тиск
- •2.2.4 Седиментація
- •2.2.4.1 Седиментаційно-дифузійна рівновага
- •2.2.4.2 Седиментаційний аналіз
- •2.2.5 Оптичні властивості дисперсних систем
- •2.2.5.1 Розсіяння світла
- •2.2.5.2 Оптичні методи дослідження дисперсних систем
- •Контрольні питання
- •Приклади розв’язку задач
- •3.1.2 Поверхневий натяг
- •3.1.3 Класифікація поверхневих явищ
- •3.1.4 Поверхневий натяг на межі двох рідин. Взаємне розтікання рідин
- •3.1.5 Адгезія і когезія. Явища розтікання та змочування
- •3.1.5.1 Поняття про когезію та адгезію
- •3.1.5.2 Змочування поверхні твердого тіла рідиною
- •3.1.5.3 Адгезія між твердим тілом і рідиною
- •3.1.5.4 Капілярні явища
- •Контрольні питання
- •3.2 Поверхневі явища на межі тверде тіло – газ, тверде тіло – рідина, рідина – газ, рідина – рідина, тверде тіло – рідина, тверде тіло – тверде тіло
- •3.2.1 Кількісна характеристика адсорбції. Величини адсорбції
- •3.2.2 Рівняння стану адсорбції
- •3.2.3 Теплота адсорбції
- •3.2.4 Залежність адсорбції від температури та природи газу
- •3.2.5 Фізична адсорбція газів і парів на гладкій твердій поверхні. Закон Генрі
- •3.2.6 Теорія адсорбції і рівняння Ленгмюра
- •3.2.7 Ізотерма адсорбції Фрейндліха
- •3.2.8 Рівняння бет (Брунауера,Еммета,Теллера)
- •Аналогічно
- •3.2.9 Швидкість адсорбції
- •3.2.10 Хімічна адсорбція газів на твердій гладкій і пористій поверхні
- •3.2.11 Капілярна конденсація
- •Отже, при сталій температурі
- •Контрольні питання
- •3.3 Електричні явища на межі тверде тіло – рідина. Будова міцели
- •3.3.1 Електрокінетичні явища
- •3.3.2 Утворення і будова подвійного електричного шару на межі тверде тіло – рідина
- •3.3.2.1 Механізм утворення пеш
- •3.3.2.2 Термодинамічне співвідношення між поверхневим натягом і електричним потенціалом
- •3.3.2.3 Теорія будови пеш Гельмгольца-Перрена
- •3.3.2.4 Теорія будови пеш Гуї-Чепмена
- •3.3.2.5 Теорія будови пеш Штерна
- •3.3.3 Вирази для дзета-потенціалу
- •3.3.4 Вплив різних факторів на дзета-потенціал
- •3.3.4.1 Вплив індиферентних електролітів
- •3.3.4.2 Вплив неіндиферентних електролітів
- •3.3.4.3 Вплив pH-середовища
- •3.3.4.4 Вплив концентрації колоїдної системи
- •3.3.4.5 Вплив температури
- •3.3.4.6 Вплив природи дисперсійного середовища
- •3.3.5 Міцелярна теорія колоїдних розчинів
- •3.3.6 Йонна адсорбція з розчинів на твердому адсорбенті
- •3.3.6.1 Йонообмінна адсорбція
- •3.4 Стійкість дисперсних систем
- •3.4.1 Види стійкості дисперсних систем
- •3.4.2 Процеси, обумовлені агрегативною нестійкістю
- •3.4.3 Фактори стійкості дисперсних систем
- •3.4.4 Коагуляція гідрофобних золів
- •3.4.4.1 Коагуляція під дією електролітів. Правило Шульце−Гарді
- •3.4.4.2 Гетерокоагуляція. Взаємна коагуляція золів
- •3.4.5 Теорії стійкості і коагуляції
- •3.4.5.1 Адсорбційна теорія коагуляції г.Фрейндліха
- •3.4.5.2 Електростатична теорія коагуляції г.Мюллера
- •3.4.5.3 Теорія стійкості систем длфо
- •3.4.5.4. Вплив концентрації електроліту на потенціальні криві взає-модії частинок
- •3.4.6 Швидкість коагуляції
- •3.4.7 Колоїдний захист
- •Контрольні питання
- •Розв’язок
- •Розв’язок
- •3.5 Характеристика мікрогетерогенних дисперних систем План
- •Металокерамічні матеріали
- •3.5.1 Дисперсні системи з газовим дисперсійним середовищем (аерозолі)
- •3.5.2 Дисперсні системи з рідинним дисперсійним середовищем
- •3.5.2.1 Суспензії
- •3.5.2.2 Емульсії
- •3.5.2.3 Латекси
- •3.5.3 Дисперсні системи з твердим дисперсійним середовищем (тверді золі, солідозолі)
- •3.5.3.1 Дисперсні системи з твердим дисперсійним середовищем і газоподібною дисперсною фазою (тверді піни)
- •3.5.3.2 Дисперсні системи з твердим дисперсійним середовищем і рідинною дисперсною фазою (тверді емульсії)
- •3.5.3.3 Дисперсні системи з твердим дисперсійним середовищем і твердою дисперсною фазою
- •3.5.4 Композиційні матеріали (композити)
- •3.5.4.1 Металокерамічні матеріали
2.1.2.6 За формою частинок дисперсної фази (за топографічною ознакою)
За цією ознакою всі дисперсні системи можна класифікувати на три класи:
а) Дисперсні системи, в яких частинки дисперсної фази володіють малими розмірами за трьома координатними напрямками (x, y, z), тобто частинки, які можна приблизно розглядати як сфери (кульки), кубики − їх називають глобулярними.
б) Дисперсні системи, в яких частинки дисперсної фази можуть бути окремими листочками, лусочками, плівками, маючи за двома напрямками великі розміри (довжину і ширину) і лише дуже малу товщину. Їх називають плівочними або пластинчастими (ламінарними) системами.
в) Дисперсні системи, в яких частинки дисперсної фази мають форму волокон, ниток, тобто характеризуються великою довжиною, але малою товщиною. Це волокнисті (фібрилярні) системи.
В обидвох останніх групах дисперсних систем, тобто в системах з різко анізодіаметричними частинками, дисперсність дисперсної фази будь-якої маси (об'єму) не залежить від того, чи складається дисперсна фаза із багатьох таких частинок чи з однієї тонкої плівки або тонкої нитки, які в цьому випадку разом з навколишнім середовищем також слід розглядати, як своєрідну дисперсну систему.
2.1.3 Одержання і очистка дисперсних систем
Колоїдні розчини займають проміжне положення між молекулярно-йонними розчинами та грубо дисперсними системами. На цьому і ґрунтуються два можливих методи одержання колоїдних розчинів: конденсаційний і диспергаційний.
Конденсація – утворення гетерогенної дисперсної системи з гомогенної в результаті агрегації (асоціації) молекул, атомів чи йонів.
Диспергація – подрібнення великих частинок грубої зависі та суспензії до колоїдної дисперсності.
У світовому виробництві речовин і матеріалів процеси диспергування і конденсації мають важливе значення. Мільярди тон сировини і продуктів одержують в високодисперсному стані. Це обумовлено особливостями речовин у цьому стані, що забезпечує зручність розфасовки, транспортування, дозування, сприяє збільшенню швидкостей хімічних реакцій і процесів розчинення, екстракції, дають можливість одержання однорідних матеріалів тощо. Наприклад, подрібнення руд, виробництво цементу, мінеральних солей і добрив, диспергація для покращення транспортування. Різко зріс випуск емульсійних, аерозольних і пастоподібних продуктів мастил, паст, кремів і т.д.
2.1.3.1 Основні методи одержання дисперсних систем
Розглянемо більш детально основні методи конденсації і диспергування, які використовуються у лабораторній і промисловій практиці.
Методи конденсації – базуються на створенні умов, при яких дисперсійне середовище фаза перенасичується речовиною наступної дисперсної фази. Від того, яким способом створюються ці умови, методи поділяються на фізичні і хімічні.
♦До фізичних методів відносяться:
а) конденсація пари в газовій фазі, в результаті чого утворюються аерозолі;
б) конденсація при пропусканні парів простої речовини у рідину, завдяки чому утворюється золь. До цього методу можна віднести електричні способи одержання дисперсій металів, що розпилюють під водою або в органічній рідині у вольтовій дузі (метод Бредіга) та в іскровому високочастотному розряді (метод Сведберга). Стабілізаторами таких дисперсій є оксиди цих металів, що одержуються як побічні продукти процесу розпилення. Оксиди адсорбуються на частинках металу і утворюють захисний шар.
в) метод одержання золів із молекулярних пучків, запропонований С.З.Рогінським та А.І.Шальніковим. Суть методу полягає в тому, що одночасно у вакуумі проводять випаровування речовини, яку диспергують, і розчинника. Змішані пари конденсуються та заморожуються (рідким повітрям). Потім суміш розморожують і збирають золь. Цей метод забезпечує абсолютну чистоту гідро- і органозолів. Таким чином одержали органозолі сірки, селену, фосфору, кадмію, калію, натрію тощо.
г) метод заміни розчинника – ґрунтується на заміні середовища, що відбувається при додаванні невеликої кількості істинного розчину речовини до розчинника, в якому ця речовина нерозчинна або малорозчинна. Це приводить до виділення її у вигляді високодисперсної системи. Наприклад, каніфоль розчиняється в етиловому спирті з утворенням істинного розчину. У воді каніфоль нерозчинна, тому при додаванні спиртового розчину каніфолі до води її молекули конденсуються в більш крупні агрегати з утворенням стійкого золю каніфолі.
♦Методи хімічної конденсації. При хімічній конденсації нова тверда фаза виникає внаслідок реакцій, продукти яких є нерозчинні в реакційному середовищі речовини. Це можуть бути реакції подвійного обміну, окисно-відновні та гідролізу. Високодисперсні золі одержують при внесенні в розбавлений розчин першого реактиву невеликої кількості концентрованого розчину другого реактиву. Останній відіграє роль стабілізатора. Нова дисперсна фаза спочатку досить часто має аморфну будову і складається з агрегатів нерозчинної речовини. З часом тверда фаза набуває кристалічної структури. Таким чином, щоб одержати золь, необхідно виконати три головні умови: дисперсна фаза повинна бути нерозчинна в дисперсійному середовищі; система повинна мати стабілізатор, який надає їй стійкості; розмір дисперсійної фази повинен відповідати розмірам колоїдного ступеня дисперсності 10-7−10-9м.
а) реакції подвійного обміну дають змогу одержати золі важкорозчинних сполук. Наприклад, при змішуванні розведених розчинів AgNO3 та KI за умови, що один з реагентів є у надлишку, аргентум йодид не випадає в осад, а утворює колоїдний розчин:
AgNO3 + KIнадл. = AgI + KNO3 .
Якщо в надлишку буде розчин KI, то міцели такого золя будуть мати таку структуру:
{[(m AgI) nI-]n- (n-x)K+}x- xK+.
Очевидно, що коли у надлишку буде AgNO3, гранула матиме позитивний заряд і іншу структуру, яка має вигляд:
{[(m AgI) nAg+]n+ (n-x)NO3─}x+ xNO3─.
б) окисно-відновні реакції дають можливості одержати золі металів і неметалів. Наприклад,
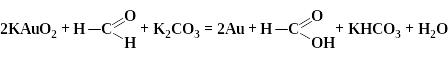
У надлишку KAuO2 ↔ K+ +AuO2- є стабілізатором міцели, яка має структуру:
{[(m Au) nAuO2-]n- (n-x)K+}x- xK+.
Одержання золю сірки:
H2S + ½O2 = S + H2O .
Під час реакції утворюється пентатіонова кислота, яка є стабілізатором:
H2S5O6 ↔ 2H+ + S5O62-.
Формула міцели:
{[(m S)n S5O62-]2n- 2(n-x)H+}2x-2 xH+.
в) реакції гідролізу дають можливість одержання золів гідроксидів важких металів. Наприклад, золь ферум (III) гідроксиду одержують за реакціями:
FeCl3 + H2O ↔ Fe(OH)Cl2 + HCl,
Fe(OH)Cl2 + H2O ↔ Fe(OH)2Cl+ HCl,
Fe(OH)2Cl+ H2O↔ Fe(OH)3+ HCl.
При цьому продуктом, який є в достатній кількості, є сполука FeОCl, яка утворюється за процесами:
Fe(OH)3+ HCl = FeОCl + 2H2O ,
Fe(OH)2Cl – H2O → FeОCl.
Ця сполука дисоціює: FeОCl ↔ FeО+ + Cl- і є стабілізатором золю, міцели якого мають будову:
{[(m Fe(OH)3)n FeО+]n+ (n-x) Cl-}x+ x Cl-.
Диспергаційні методи – найчастіше застосовуються для одержання грубодисперсних систем – суспензій, емульсій, порошків.
Механічне подрібнення проводять у спеціальних промислових і лабораторних пристроях – млинах. Найбільш поширені шарові та планетарні млини. У них матеріал підлягає грубому диспергуванню до частинок розміром 10-4 – 10-5 м. В результаті вивчення механізму диспергування твердих тіл було встановлено, що при деформації твердого тіла на його поверхні утворюються мікротріщини, що і служить головною причиною різкого пониження міцності. У твердих тілах дефекти розташовані в об’ємі так, що ділянки твердого тіла між ними мають в середньому розміри біля 10-6 – 10-7 м. Тому такий помол проводять у вібромлинах та колоїдних млинах. Ці прилади використовують для диспергування твердих матеріалів і рідин у рідкому середовищі при одержанні суспензій та емульсій. Диспергування проводять за допомогою речовин, які стабілізують дисперсію: поверхнево-активних речовин, електролітів, високомолекулярних сполук. Однак ці речовини виступають не тільки як стабілізатори. У працях Ребіндера показано, що такі речовини адсорбуються в місцях дефектів кристалічної гратки твердих тіл, наприклад, мікротріщинах, тобто в місцях, де величина поверхневого натягу більша порівняно з іншими ділянками твердої поверхні. Адсорбція ПАР спричинює зниження поверхневої енергії, чим полегшує диспергування. Адсорбція ж електролітів сприяє виникненню сил взаємного електростатичного відштовхування адсорбційних шарів, розташованих на протилежних боках мікротріщин. Так виникає розклинювальний ефект, який підсилює руйнівну дію. Це явище називають ефектом Ребіндера.
Адсорбційне пониження міцності має велике практичне значення. Воно використовується при бурінні гірських порід, при обробці металів і т.п.
Отже, при простому механічному подрібненні утворюються частинки, розміри яких не менші декількох мікрометрів. Це зумовлене тим, що при механічному подрібненні відбувається і злипання частинок. Тому, для подальшого диспергування потрібен третій компонент.
Але, в цілому, методи диспергування значно поступаються методам конденсації по дисперсності одержаних систем і навіть в присутності стабілізатора рідко вдається одержати системи, в яких частинки мають розміри, менші 1 мкм.
Електричні методи диспергування ґрунтуються на тому, що електроди, виготовлені з диспергованого металу, занурюють у рідке середовище і випаровують у вольтовій дузі. При конденсації парів речовини електродів утворюється колоїдна система. Метод має обмежене застосування – можна одержати гідрозолі тільки з благородних металів.
Акустичні методи ґрунтуються на використанні напрямленого ультразвукового поля (частота 105 – 106 Гц). Диспергування відбувається в результаті кавітаційного руйнування (при чергуванні стиснень і розріджень у рідині). Таке явище викликає великі механічні руйнівні сили. Останні спроможні диспергувати не тільки рідини, а й тверді частинки.
Пептизація. Цей метод можна формально віднести до диспергаційних методів, оскільки тут відсутній процес подрібнення великих частинок до розмірів колоїдних дисперсій. Це швидше дезагрегація частинок осаду розпушеної структури, між якими є прошарки дисперсійного середовища.
Розрізняють три способи пептизації: адсорбційну, хімічну і промивання осаду розчинником.
Адсорбційна пептизація спостерігається при додаванні до осаду такого електроліту, йони якого здатні до вибіркової адсорбції згідно з правилом Паннета-Фаянса. Наприклад, осад Fe(OH)3 можна одержати за реакцією:
FeCl3 + 3NH4OH = Fe(OH)3 + 3NH4Cl.
А золь Fe(OH)3 можна одержати, якщо утворений осад Fe(OH)3 обробити розчином з йонами-пептизаторами, які вибірково адсорбуються на осаді. У даному випадку це може бути йон Fe3+ . Тоді міцела має вигляд:
{[(m Fe(OH)3)n Fe3+]3n+ 3 (n-x) Cl-}3x+ x Cl-.
Хімічна пептизація відбувається, якщо до осадів, які не мають ПЕШ на своїх частинках, добавити речовин, що вступають в реакцію з поверхнею осаду. Наприклад, осад Fe(OH)3 можна обробити невеликою кількістю HCl для утворення пептизатора FeOCl, який утворюється під час реакції:
Fe(OH)3 + HCl ↔ FeOCl + 2H2O,
а FeOCl дисоціює:
FeOCl ↔ FeO+ + Cl-,
а йон FeO+ і є йоном-пептизатором. Тоді формула міцели така:
{[(m Fe(OH)3)n FeО+]n+ (n-x) Cl-}x+ .
Метод промивання розчинником. Наприклад, до осаду Fe(OH)3 добавимо чистий розчинник. Тоді золь Fe(OH)3 до промивання осаду має формулу:
{[(m Fe(OH)3)n Fe3+]3n+ 3 n Cl-}0 ,
а після промивання:
{[(m Fe(OH)3)n Fe3+]3n+ 3 (n-х) Cl-}3х+3хCl-.
Заряди (3х+) колоїдних частинок створюють сили відштовхування між ними і сприяють переходу осаду в колоїдний стан. Зовнішньо це нагадує процес розчинення денатурованих білків під дією пепсину. Звідси і походить термін „пептизація”.
