
- •Курсовая работа
- •1. Введение
- •2. Литературный обзор
- •2.1 Металлокерамика
- •2.2 Композиции и керамика на основе диоксида циркония
- •2.3 Композиции и керамика диоксида циркония, стабилизированного оксидом иттрия и содержащим CuO.
- •3. Экспериментальная часть
- •3.1 Получение реагентов для синтеза
- •3.1.1 Получение СuO
- •3.1.2 Приготовление раствора ZrO(Cl)2
- •3.1.3 Приготовление раствора ZrO(no3)2
- •3.1.4 Анализ растворов ZrO(no3)2 и ZrO(Cl)2
- •3.1.5 Получение композиции ZrО(oh)2 – y(oh)3 – Cu(oh)2
- •3.2 Охрана труда
- •3.3 Результаты экспериментов.
- •3.3.1 Получение параметров кинетики первого периода свч сушки порошка системы ZrО(oh)2 – y(oh)3 – Cu(oh)2.
- •3.3.2 Зависимость потери массы образца от температуры.
- •3.3.3 Исследование образцов ик-спектроскопией
- •3.3.4 Исследования эпр
- •3.3.5 Рентгенофазовый анализ
- •Литература
3.3.2 Зависимость потери массы образца от температуры.
Провели изучение потери массы при прокаливании образцов при разной температуре, по полученным данным получили график с кривыми зависимости потери массы от температуры:
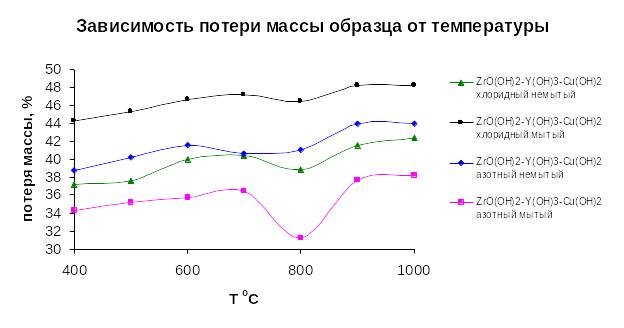
Рисунок 3.2 Зависимость потери массы образца от температуры.
Проанализировав график можно выделить несколько закономерностей и особенностей:
1. При температуре от 1000оС и далее потеря массы практически прекращается, и линии зависимостей выходят на плато в районе 1000оС.
2. Можно заметить что в 3 образцах в разной степени потеря массы в районе 800оС уменьшается, что может говорить о протекании реакций внутри образцов и с окружающей средой в аппарате, только для ZrО(OH)2 – Y(OH)3 – Cu(OH)2 азотный немытый эта зависимость характерна для 700оС.
3. Также необходимо заметить эти изменение потерь массы в сторону уменьшения более выражены для «немытых» образцов, но что может говорить о более идеальной структуре материала, что ведет к уменьшению реакционной способности или уменьшению способности вступать в побочные реакции.
3.3.3 Исследование образцов ик-спектроскопией
Провели ИК-спектроскопию полученных порошков, протираем спиртом прибор для создания таблеток, пестик, ступку, шпатель, и готовим в ступке необходимую смесь – смешивают 0,03 г КBr и 0,001 г полученного нами порошка. Все тщательно растираем и перемешиваем. Из растертого и перемешенного порошка взвешиваем 0,015 г для образования таблетки, взвешенный порошок переносим в аппарат формирования таблетки таким образом, чтобы слой порошка был равномерно распределен. Аппарат для формирования таблеток ставим под пресс и даем нагрузку 16 атмосфер/см2. Забираем из под пресса аппарат, и достаем готовую таблетку. С полученных таблеток снимаем ИК-спектрограмму проходящего типа на приборе TENSOR 27 “BRUKER”.
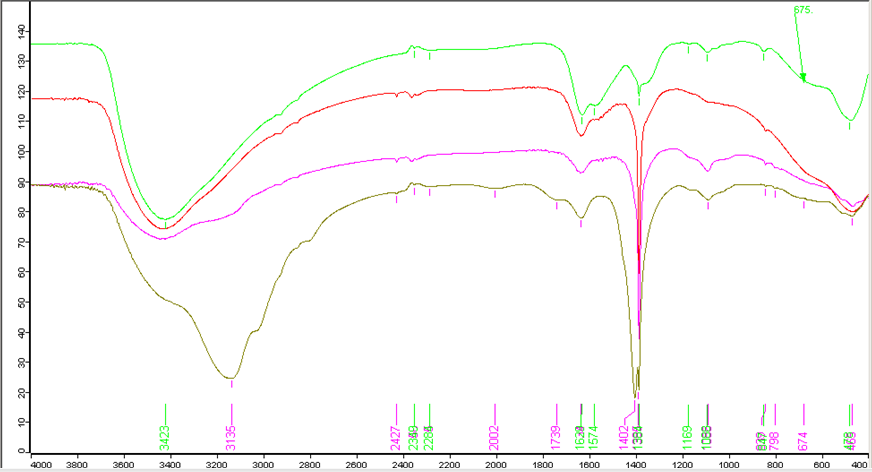
Рисунок 3.3 ИК-спектрограмма порошков после СВЧ-сушки.
 ZrО(OH)2–Y(OH)3–Cu(OH)2
азотный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2
азотный немытый
 ZrО(OH)2–Y(OH)3–Cu(OH)2
азотный мытый
ZrО(OH)2–Y(OH)3–Cu(OH)2
азотный мытый
 ZrО(OH)2–Y(OH)3–Cu(OH)2
хлоридный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2
хлоридный немытый
 ZrО(OH)2–Y(OH)3–Cu(OH)2
хлоридный мытый
ZrО(OH)2–Y(OH)3–Cu(OH)2
хлоридный мытый
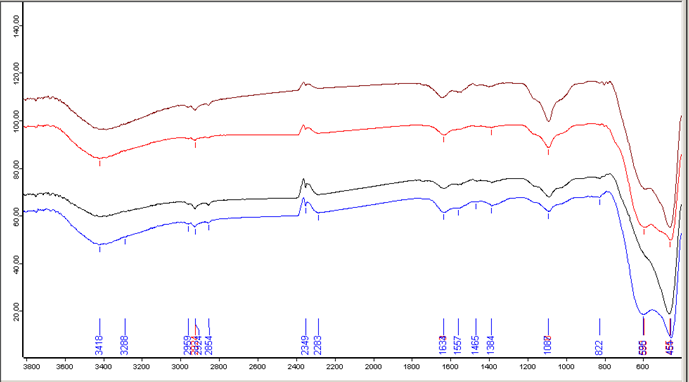
Рисунок 3.4 ИК-спектрограмма порошков после термостатирования при 700оС.

 ZrО(OH)2–Y(OH)3–Cu(OH)2
азотный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2
азотный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный мытый
 ZrО(OH)2–Y(OH)3–Cu(OH)2
хлоридный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2
хлоридный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный мытый
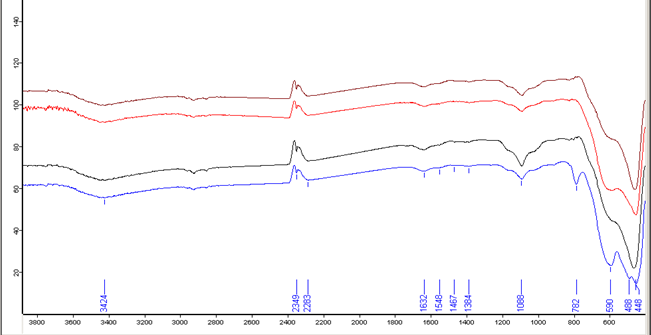
Рисунок 3.5 ИК-спектрограмма порошков после термостатирования при 900оС.
ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный мытый
ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный мытый
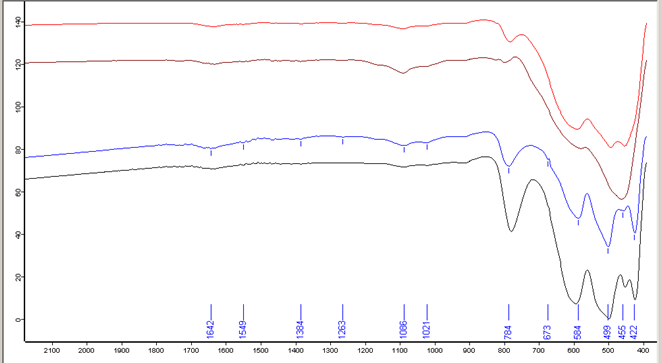
Рисунок 3.6 ИК-спектрограмма порошков после термостатирования при 1000оС.
ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный мытый
ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный немытый
ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный мытый
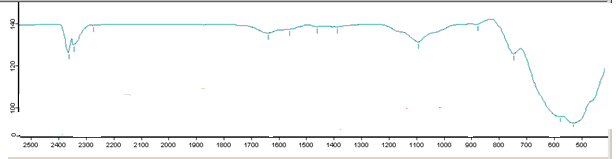
Рисунок 3.7 ИК-спектрограмма для композиции ZrО(OH)2–Y(OH)3, где ZrO2 – 97% мол, Y2O3 – 3% мол. при температуре 890оС.
Проанализировав данные ИК-спектрограммы, можно дать информацию:
1. После сушки в порошке находятся NH4NO3, который обнаруживается линиями NO3- - 1385; 798 см-1, NH4+ - 1402 см-1. Колебания композиции характеризуются такими пиками: 1088; 839 (847); 674; 465 (деформационные колебания меди) см-1. Колебания в диапазоне 2200-2400 см-1 относятся к колебаниям СО2. Линия 1639 см-1 скорее связана с присутствием воды или ОН связей. Также есть линия, которая характерна для аммиачных комплексов меди (с к.ч. 2; 4) – 3423-3460 см-1. В образце ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный немытый можно также выделить кроме всего прочего также NH4Cl – 1402; 1749; 2002 см-1, а также NH3 – 3135; 1574; 1169 см-1.
2. Анализируя ИК-спектрограмму при 700оС, можно сказать пики, находящиеся в диапазоне 2800-3000 см-1 вызваны, скорее всего, попаданием в ИК-таблетку ворсинки или волосинки, которые являются органическими веществами и дающими сигнал в этой области. Колебания в диапазоне 2200-2400 см-1 также относятся к колебаниям СО2. Колебания композиции стали более выражены. Наблюдается значительное уменьшение присутствия NH4NO3, однако оно определяется пиками – 1455; 1384; 822 см-1. Существенно уменьшается концентрация аммиакатов меди – 3418 см-1. Также зафиксировано небольшое количество NH3 для ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный мытый, из-за разложения значительной части аммиакатов меди, подтверждается пиками – 3260; 1567 см-1. Можно утверждать, что пик 1639 см-1 отвечает наличию ОН связей в гидроксидах металлов, и при 700оС уменьшается незначительно. Появляется полоса характеризующая систему ZrO2-Y2O3-CuO – 1455; 595 см-1.
3. Анализируя ИК-спектрограмму при 900оС, видно что колебания в диапазоне 2200-2400 см-1 относятся к колебаниям СО2. Наблюдаются следовые количества NO3- - 1384 см-1. Наблюдается малая концентрация аммиачных комплексов меди – 3424 см-1. Пик 1632 см-1 отвечает наличию ОН связей в гидроксидах металлов, и при 900оС уменьшается значительно. Полосы, характеризующие систему ZrO2-Y2O3-CuO, сохраняются прежними и для 900оС – 1457; 590 см-1, появляется новый пик характеризирующий систему – 1548 см-1. Пик 782 см-1 для ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный мытый появляется вследствие значительного содержания моноклинной фазы в этом образце (22,6%) по сравнению с другими образцами (где мах=2,5%).
4. Анализируя ИК-спектрограмму при 1000оС, наблюдается отсутствие аммиачных комплексов меди. Пик 1642 см-1 отвечает наличию ОН связей в гидроксидах металлов, и при 1000оС остается в следовых количествах. Наблюдаются следовые количества NO3- - 1384 см-1 только для образца ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный немытый, в остальных образцах NO3- отсутствует. Пик 784 см-1 характеризует моноклинность фазы и его интенсивность зависит от доли моноклинной фазы, чем она больше тем больше интенсивность пика(азотный мытый =70%; азотный немытый =66,5%; хлоридный мытый =23%; хлоридный немытый =5%). Остальные пики характерны системе ZrO2-Y2O3-CuO.
