
- •Курсовая работа
- •1. Введение
- •2. Литературный обзор
- •2.1 Металлокерамика
- •2.2 Композиции и керамика на основе диоксида циркония
- •2.3 Композиции и керамика диоксида циркония, стабилизированного оксидом иттрия и содержащим CuO.
- •3. Экспериментальная часть
- •3.1 Получение реагентов для синтеза
- •3.1.1 Получение СuO
- •3.1.2 Приготовление раствора ZrO(Cl)2
- •3.1.3 Приготовление раствора ZrO(no3)2
- •3.1.4 Анализ растворов ZrO(no3)2 и ZrO(Cl)2
- •3.1.5 Получение композиции ZrО(oh)2 – y(oh)3 – Cu(oh)2
- •3.2 Охрана труда
- •3.3 Результаты экспериментов.
- •3.3.1 Получение параметров кинетики первого периода свч сушки порошка системы ZrО(oh)2 – y(oh)3 – Cu(oh)2.
- •3.3.2 Зависимость потери массы образца от температуры.
- •3.3.3 Исследование образцов ик-спектроскопией
- •3.3.4 Исследования эпр
- •3.3.5 Рентгенофазовый анализ
- •Литература
3.3 Результаты экспериментов.
3.3.1 Получение параметров кинетики первого периода свч сушки порошка системы ZrО(oh)2 – y(oh)3 – Cu(oh)2.
Задачей данной работы является получение параметров кинетики первого периода СВЧ сушки, то есть получение формального кинетического уравнения с определением константы скорости Кс и кинетический параметр (порядок реакции) n согласно уравнению Казеева – Ерофеева – Колмагорова с поправкой Саковича.
Первым периодом сушки называется период в пределах которого влагосодержание материала уменьшается линейно, т. Е. скорость удаления влаги сохраняет свою величину. В первом периоде постоянной скорости сушки преобладающим является наружное диффузионное сопротивление отводу образующихся паров влаги от поверхности материала. Крупные поры с малым гидравлическим сопротивлением переносу влаги из внутренних зон материала к его наружной поверхности первыми освобождаются от влаги. В дальнейшем влага удаляется из мелких пор, обладающих значительным гидравлическим сопротивлением. Перемещение влаги к поверхности уже не успевает обеспечивать прежнюю скорость ее испарения с наружной поверхности материала, и общая скорость сушки начинает непрерывно уменьшаться вслед за возрастанием внутреннего сопротивления переносу влаги по капиллярно-пористой структуре материала.
Кинетика реакций хорошо описывается обобщенным уравнением кинетики топохимических реакций, в том числе сушки выведенное Ерофеевым в 1946г.
![]()
Позднее это уравнение приведено к наиболее известному в настоящее время виду топокинетического уравнения применительно к реакциям твердых веществ.
![]()
где n
– кинетический
параметр;
-
это степень превращения (степень удаление
влаги);
![]() -
время;
-
время;
![]() -
постоянная, определяющая константу
скорости реакции.
-
постоянная, определяющая константу
скорости реакции.
Это уравнение известно как Уравнение Казеева – Ерофеева – Колмогорова.
Константа скорости может быть рассчитана по уравнению поправки Саковича.
![]()
В качестве объекта исследования выступает система ZrО(OH)2 – Y(OH)3 – Cu(OH)2 в таком мольном соотношении (мольные проценты): Zr(OH)4 – 96; Y(OH)3 – 3; Cu(OH)2 – 1.
В эксперименте были задействованы четыре образца ZrО(OH)2 – Y(OH)3 – Cu(OH)2 синтезированы из двух видов сырья циркония: хлоридного и азотнокислого. На каждый вид сырья приходится два образца: первый – это осадок полученный обратным осаждением с помощью раствора аммиака стехиометрической смеси солей циркония, иттрия и меди, в дальнейшем осадок был отфильтрован с помощью вакуумного насоса – «немытый», второй – получен также, но был промыт одним литром воды на фильтре – «мытый». В дальнейшем все образцы поддавались СВЧ сушки с мощностью 700 ватт, периодически навески образцов взвешивались. Температура в СВЧ печи поддерживалась на уровне 100 оС. Были получены данные, которые были обработаны и их основании была построена диаграмма в координатах уравнения Казеева – Ерофеева – Колмагорова:
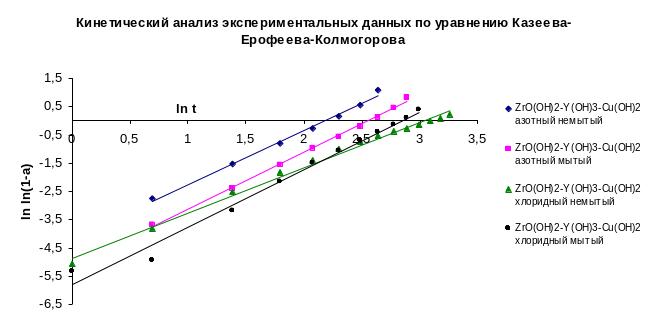
Рисунок 3.1 Кинетический анализ удаления воды в первом периоде сушки.
Согласно анализа экспериментальных данных получили следующие кинетические уравнения для образцов:
ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный немытый – y=1,9133х-4,1778; R2=0,9942.
ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный мытый – у=2,0069х-5,1432; R2=0,9975.
ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный немытый – у=1,7050х-4,9934; R2=0,9973.
ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный мытый – у=2,0396х-5,8187; R2=0,9856.
Были проведены расчеты констант скоростей и определены кинетические параметры, данные представлены в виде таблиц:
Таблица 3.1
Данные констант скоростей и кинетических параметров образцов ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный.
ZrО(OH)2–Y(OH)3–Cu(OH)2 азотный |
||
|
Не мытый |
мытый |
Кс , мин-1 |
0,21395 |
0,15532 |
ln Kс |
-1,54201 |
-1,86229 |
n |
1,91 |
2,01 |
Таблица 3.2
Данные констант скоростей и кинетических параметров образцов ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный
ZrО(OH)2–Y(OH)3–Cu(OH)2 хлоридный |
||
|
Не мытый |
мытый |
Кс , мин-1 |
0,09203 |
0,11751 |
ln Kс |
-2,38557 |
-1,86229 |
n |
1,71 |
2,04 |
По Ерофееву число n – характеризует форму пор и равное 3 при образовании сферических пор, 2 – цилиндрических и 1 – плоских. По полученным результатам мы можем увидеть, что для мытых образцов характерно четкое образование цилиндрических пор, в то время когда для немытых поры только стремятся к цилиндрическим формам.
Значения констант скоростей для образцов системы ZrО(OH)2–Y(OH)3–Cu(OH)2 можно объяснить результатами анализа БЭТ:
Таблица 3.3
Результаты БЭТ анализа.
Удельная поверхность (метод БЭТ) |
|||
|
Удельная поверхность, м2/г |
Удельный объем монослоя мл НТД/г |
Константа БЭТ |
Zr3Y1Cu (NO3) nm |
150,1 |
34,47 |
74 |
Zr3Y1Cu (NO3) m |
305,5 4,5 |
70,15 |
71 |
Zr3Y1Cu (Cl) nm |
129,4 1,7 |
29,72 |
63 |
Zr3Y1Cu (Cl) m |
313,6 4,1 |
72,02 |
77 |
Удельная поверхность мезопор (метод STSA) |
|||
|
Удельная поверхность, м2/г |
Объем микропор, см3/г |
Полный объем пор, см3/г |
Zr3Y1Cu (NO3) nm |
128,4 3,3 |
0,008 |
0,113 |
Zr3Y1Cu (NO3) m |
275 4,2 |
0,010 |
0,259 |
Zr3Y1Cu (Cl) nm |
130,8 3,3 |
- |
0,124 |
Zr3Y1Cu (Cl) m |
257,7 17,4 |
0,021 |
0,247 |
Константа скорости для ZrО(OH)2–Y(OH)3–Cu(OH)2 из азотнокислого сырья «немытый» больше так как удельная поверхность его меньше чем у «мытого» что говорит о том что размер частиц у «немытого» больше и часть пор с радиусом от 9,0–19,4 нм в 1,8 раза больше, при этом пористость в два раза больше. Доля пор с радиусом 1,1–1,9 нм у «мытого» и «немытого» согласно распределению пор практически одинакова.
Константа скорости для ZrО(OH)2–Y(OH)3–Cu(OH)2 из хлоридного сырья «немытый» меньше, хотя соотношение полного объема пор и удельной поверхности практически такое же как для азотного, а то что константа меньше чем у «мытого» объясняется тем что доля пор с радиусом 1,1–1,9 нм у «немытого» на треть больше, а удаление влаги из мелких пор сопровождается значительным гидравлическим сопротивлением.
