
- •Дефекты кристаллической решетки
- •Перемещение атомов в твердых и жидких телах
- •Структура и свойства оксидов железа
- •Термодинамика восстановления оксидов железа
- •Особенности восстановления оксидов при наличии растворов
- •Восстановление оксидов находящихся в растворе
- •Переход продукта восстановления в раствор
- •Кинетика и механизм восстановления оксидов
- •Современные представления о механизме восстановления оксидов
- •Внешняя диффузия газа
- •Диффузия газа в порах кускового материала
Особенности восстановления оксидов при наличии растворов
Восстановление оксидов находящихся в растворе
Рассмотрим восстановление оксидов на примере FeO, раствор энного в железе. Непрямое восстановление происходит следующим образом:
[Fe0]TB + C0-Fe1B + C02. (2.42)
Система трехкомпонентна. Если раствор ненасыщен, то число фаз равно 2 (раствор и газ), а число степеней свободы — 3. В насыщенных растворах добавляется оксидная фaза, находящаяся в равновесии с раствором, и система становится двухвариантной. Из параметров, влияющих на положение равновесия, необходимо исключить давление, так как превращение протекает без изменения объема. Следовательно, в ненасыщенных растворах равновесный состав газа определяется двумя величинами: температурой и концентрацией, а в насыщенных, так же как при отсутствии растворов, — только температурой:
![]() (2.43)
(2.43)
где аFe b aFeO – активность железа и его оксида соответственно; СО2 и СО – равновесные концентрации СО2 иСО при восстановлении раствора.
Если
аFe
=
1 и aFeO
=
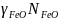 где
где
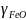 -
коэффициент активности вюстита;
-
коэффициент активности вюстита;
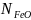 - мольная доля вюстита в растворе, а К’
= CO2/CO
(для восстановления чистых фаз), получим
- мольная доля вюстита в растворе, а К’
= CO2/CO
(для восстановления чистых фаз), получим
CO’2/CO’ = (CO2/CO) (2.44)
Отсюда следует, что в ненасыщенных растворах ( < 1) равновесный газ беднее СO2 и богаче СО, чем при восстановлении чистых фаз. С уменьшением концентрации FeO уменьшается отношение СO2/СO, т. е., чем ниже содержание оксида, тем труднее его восстанавливать и тем богаче восстановителем должна быть газовая смесь. Это объясняется понижением упругости диссоциации и повышением прочности оксида по мере уменьшения его концентрации в растворе.
Прямое восстановление происходит по схеме
FeO + СО = Fe + С02
С02 + С = 2СО
FeO + С = Fe + СО. (2.45)
Система в ненасыщенных растворах двухвариантна, а при постоянном давлении имеет одну степень свободы. Температура равновесия становится функцией концентрации FeO. По мере уменьшения концентрации оксида его становится труднее восстановить, что, в частности, проявляется в повышении температуры начала реакции.
Переход продукта восстановления в раствор
Рассмотрим восстановление МnО, когда продукт реакции (марганец) растворяется в железе (в реальных условиях без перевода марганца в раствор приводимая реакция не идет):
МnОта + СО = [Mn]Fe+ С02. (2.46)
Число компонентов равно 4 (добавляется железо). Оксид марганца малорастворим в железе и практически образует самостоятельную фазу. В ненасыщенном растворе марганца в железе система трехфазна (раствор марганца в железе, МnО и газ) и трехвариантна, а равновесный состав газа — функция температуры, давления и концентрации марганца. Пренебрегая влиянием давления, получаем следующую зависимость:
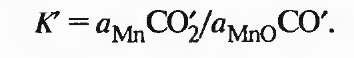 (2.47)
(2.47)
При
aМnО
= 1 и aMn
=
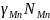 получаем
получаем
СО'2/СО'= (C02/C0)(l/ ). (2.48)
Отсюда вытекает, что в присутствии растворителя железа, когда N < I, равновесный состав газа беднее оксидом углерода, чем при получении чистого металла. Следовательно, при переводе продукта реакции в раствор восстановление оксида облегчается, так как увеличивается его упругость диссоциации. При прямом восстановлении облегчение условий для протекания реакции проявляется в снижении температуры равновесия.
