
- •Дефекты кристаллической решетки
- •Перемещение атомов в твердых и жидких телах
- •Структура и свойства оксидов железа
- •Термодинамика восстановления оксидов железа
- •Особенности восстановления оксидов при наличии растворов
- •Восстановление оксидов находящихся в растворе
- •Переход продукта восстановления в раствор
- •Кинетика и механизм восстановления оксидов
- •Современные представления о механизме восстановления оксидов
- •Внешняя диффузия газа
- •Диффузия газа в порах кускового материала
Структура и свойства оксидов железа
Железо образует с кислородом три стабильных оксида: Fe^O, Fe304и Fe203(pHC. 2.2). Вюстит Fe^O может содержать от 23,1 до 25,6% О. Отсюда видно, что стехиометрическое отношение Fe : О = 1, соответствующее 22,3% 02, не достигается. Вюстит имеет гранецентрированную кубическую решетку типа NaCl. Если все узлы решетки, соответствующие ионам кислорода, заняты, то в узлах ионов железа имеются вакансии. Считают, что из-за этого в решетке должно находиться эквивалентное число ионов трехвалентного железа, иначе не выполнилось бы условие электронейтральности.
Избыточные положительные заряды ионов железа могут передвигаться по решетке между ионами двух- и трехвалентного железа. Эти заряды называют дефектными электронами, они являются носителями электричества и причиной электропроводности вюстита. Благодаря наличию вакансий ионов железа возможно передвижение ионов железа по решетке, при этом сама вакансия блуждает в противоположном направлении. Между коэффициентом самодиффузии железа в вюстите (Z)*Fe) и коэффициентом
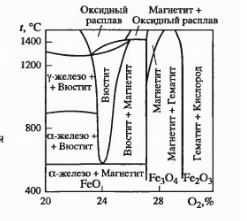
Рис 2.2. Диаграмма состояния Fe – O
Таблица 2.2.
Состав и параметры вюстита
Состав |
Количество железа, ат. % |
Постоянная решетка, нм |
Плотность, г/см3 |
Fe0.91O |
47.68 |
0.4282 |
5.613 |
Fe0.92O |
47.85 |
0.4285 |
5.624 |
Fe0.93O |
48.23 |
0.4292 |
5.658 |
Fe0.945O |
48.65 |
0.4301 |
5.728 |
диффузии вакансий (DB)существует следующая зависимость:
yDB= (1 ~y)D*fe- (2.7)
Коэффициент диффузии вакансий в основном не зависит от концентрации вакансий уи, по данным Богданди и Энгеля,
DB= D°Bехр[ —27800/(Л7)], (2.8)
где Z)° = 4,5-10~2 см2/с.
В соответствии с тем, что дефицит железа имеет следствием известную концентрацию вакансий, следует принять, что в гипотетическом стехиометрическом вюстите некоторое число ионов железа покидает свои узлы и переходит в положение ионов междоузлий. С концентрацией вакансий постоянная решетка вюстита меняется почти линейно (табл. 2.2).
При 570 °С равновесные линии Fe—Fe^O и Fej О—Fe304пересекаются. Следовательно, ниже этой температуры вюстит должен распадаться на железо и магнетит. Магнетит имеет решетку типа шпинели. Параметр решетки а колеблется от 0,8378 до 0,8397 нм. Если ионы железа изоморфно замещены другими элементами в соединении типа Ме^—Fe3^,0, то а может изменяться в пределах 0,80—0,89 нм. Для шпинелеи характерно, что кислород в решетке образует самую плотную кубическую упаковку. Элементарная ячейка шпинели включает 32 иона кислорода, они охватывают 64 тетраэдрических и 32 октаэдрических узлов решетки, в которые могут быть встроены ионы металла. В ячейке 32 ионам кислорода соответствуют 24 иона металла. Если решетка идеальная, на них приходится 8 из 64 тетраэдрических (или A-узла) и 16 из 32 октаэдрических пустот (или В-узла).
При заполнении октаэдрических и тетраэдрических вершин ионами металла возможны два граничных случая. Первый характеризуется нормальным катионным распределением, когда все двухвалентные ионы находятся в A-узлах, например ZnFe204. Во втором случае вершины октаэдра заня гы ионами различной валентности. Такую структуру, называемую обращенной шпинелью, имеет магнетит. Бывает и смешанное катионное распределение (табл. 2.3).
Таблица 2.3
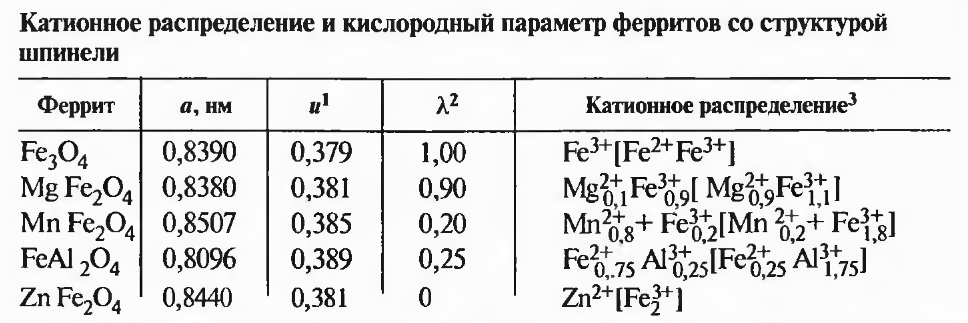
Кислородный параметр и — количественный показатель смешения ионов кислорода вдоль пространственной диагонали куба; определяется из соотношения аи, равного расстоянию между ионами кислорода и гранью куба; для идеальной решетки шпинели ит = 0,375.
Степень обращенности решетки X равна доле ионов повышенной валентности в А-узлах.
В символах катионного распределения в квадратных скобках отмечено положение ионов в В-узлах.
В твердых растворах из шпинелей, одна из которых представлена нормальной, а другая — обращенной, возможен переход из одного типа в другой. Некоторые чистые шпинели можно представить как твердый раствор одной нормальной и одной обратной шпинели одинакового химического состава, например магнезиоферрит Fe^xMg2+[Fe]+xMg]^x]04. Подобные твердые растворы, особенно при небольших отклонениях от одной из граничных структур, можно описывать как разупорядоченные нормальные и обращенные шпинели.
Возможен и другой тип разупорядочения, когда оказываются занятыми такие вершины, которые в идеальном кристалле должны быть свободными, а соответствующее число вершин, которые в идеальном случае должны быть занятыми, остаются незаполненными.
Оба типа разупорядочения играют важную роль в диффузии ионов железа в магнетите. Более высокий порядок кислородной части решетки обусловливает более низкую величину коэффициента диффузии кислорода по сравнению с коэффициентом диффузии железа. Обмен электронами между двух- и трехвалентными ионами железа, находящимися в "ершинах октаэдров, происходит довольно легко, чем и объясняется высокая электропроводность оксида. Магнетит слабо растворяется в a-Fe203, причем предельная растворимость растет сувеличением температуры. Образующийся твердый раствор, видимо, относится к растворам внедрения.
Таблица 2.4
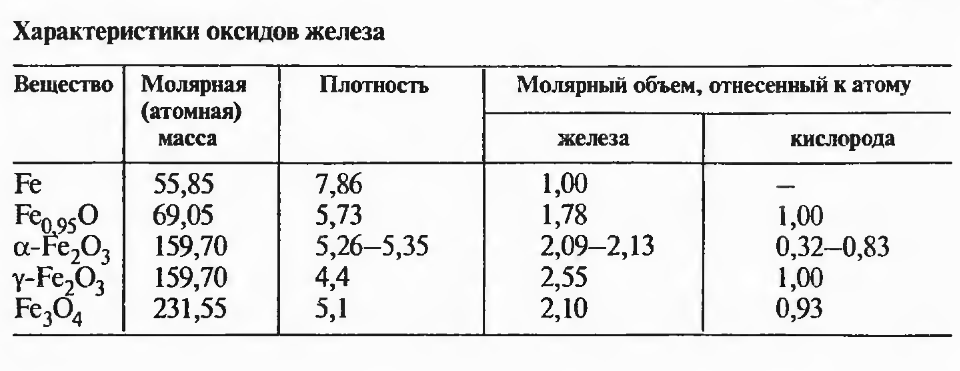
При нагреве магнетит может принимать избыток оксида трехва- лешного железа. Некоторые сведения об искажении решетки при отклонениях от стехиометрического состава магнетита может дать рассмотрение магтемита (y-Fe203). Это соединение имеет такую же структуру, как машетит, однако в каждой элементарной ячейке с 32 ионами кислорода 2 2/з вершин октаэдра, за] штых hoi [ами железа, здесь остаются незаполненным^ Экспериментально установлено, что подобная структура характерна и для магнетита, принявшего избыток кислорода. Коэффициент самодиффузии железа пропорционален парциальному давлению кислорода: Dp* ~Pq£.
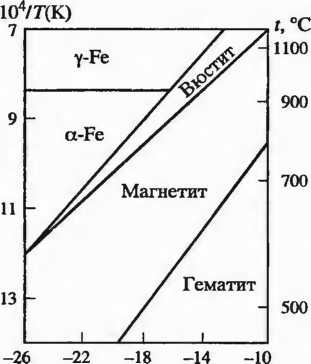
Рис. 2.3. Термодинамические области устойчивости оксидов железа
Магнетит ферромагнитен, температура Кюри 627 °С. При окислении магнетита можно получить различные оксидные фазы, отвечающие одинаковому химическому составу Fe203. Устойчивым является гематит Р — Fe203, имеющий тригональную решетку и этим отличающийся от остальных оксидов железа (табл. 2.4). Параметр решетки а = 0,5427 нм. Гематит является антиферромагнетиком.
Маггемит у — Fe203(а = 0,8322—0,8340 нм) получают при определенных условиях (главное, невысокая температура). Как и магнетит, он •Ферромагнитен. Иногда отмечают наличие на третьей модификации Fe203: (3 = Fe203, свойства которой исследованы мало. Термодинамические области устойчивости оксидов железа приведены на рис. 2.3.
