
- •Очистка сточных вод
- •Введение
- •1 Группа
- •3 Группа
- •4 Группа
- •1. Решетка; 2 - бесконечная цепь; 3 грабли
- •Пример расчета решеток
- •Значение коэффициента Таблица 1
- •Р ис.4 Песколовки с круговым движением воды:
- •Расчет песколовок
- •Аэрируемые песколовки
- •Пример 1 Горизонтальная песколовка
- •Пример 2 Аэрируемая песколовка
- •Отстойники
- •Радиальные отстойники
- •Расчет вертикального отстойника
- •Расчет горизонтальных отстойников
- •Пример расчета горизонтального отстойника
- •Септики
- •Гидроциклоны
- •Ц ентрифуги
- •Очистка сточных вод от маслопродуктов
- •Флотация
- •Вакуумная флотация
- •Напорная флотация
- •И мпеллерная флотация
- •Электрофлотация
- •Пример расчета напорного флотатора
- •Барботажные абсорберы
- •Адсорберы с псевдоожиженным слоем активного угля
- •Абсорберы с механическим перемешиванием жидкости
- •Полые распыливающие абсорберы и циклонный скрубер
- •Фильтры
- •Микрофильтры
- •Каркасные фильтры
- •Открытые фильтры
- •Фильтры с плавающей загрузкой
- •Фильтры с эластичной загрузкой
- •Биохимическая очистка сточных вод
- •Состав активного ила и биопленки
- •Закономерности распада органических веществ
- •Нитрификация и денитрификация
- •Серосодержащие вещества
- •Окисление железа и марганца
- •Зависимость скорости биологической очистки от различных факторов
- •Абсорбция и потребление кислорода
- •Сооружения биологической очистки сточных вод Преаэраторы и биокоагуляторы
- •Биологические фильтры
- •Общие указания
- •Орошение загрузки биофильтров
- •Капельные биологические фильтры
- •Высоконагружаемые биологические фильтры Аэрофильтры
- •Биофильтры с пластмассовой загрузкой
- •Погружные дисковые фильтры
- •Барабанные погружные биофильтры
- •Примеры расчетов биофильтров Пример 1
- •Пример 2
- •Пример 3
- •Пример 4
- •Пример 5
- •Пуск био-, аэрофильтров в работу
- •Аэротенки
- •Аэраторы
- •Пуск аэротенков
- •Примеры расчетов аэротенков Пример 1
- •Пример 2
- •Пример 3
- •Циркуляционные окислительные каналы (цок)
- •Расчет цок
- •Пример расчета цок
- •Биохимическая очистка сточных вод в окситенках
- •Пример расчета окситенка
- •Характеристики дисковых механических аэраторов поверхностного типа
- •Метантенки
- •Пример расчета метантенка
- •Аэрационные установки на полное окисление (аэротенки с продленной аэрацией)
- •Доочистка в биологических прудах
- •Расчет биологических прудов
- •I. Пруды с естественной аэрацией
- •П. Пруды с искусственной аэрацией
- •Пример расчета биологического пруда
- •Пример расчета поля фильтрации
- •Поля подземной фильтрации
- •Фильтрующие колодцы
- •Химическая и фзико - химическая очистка сточных вод
- •Коагуляция
- •Электрокоагуляция
- •Ионобменное обессоливание сточных вод
- •Расчет ионообменной очистки сточных вод
- •Обессоливание воды электродиализом
- •Обессоливание воды методом обратного осмоса
- •Узел очистки
- •Узел обратного осмоса
- •Узел декарбонизации
- •Узел деминерализации воды
- •Установки для обеззараживания сточных вод
- •Анализ сточных вод прошедших очистку
- •Определение взвешенных веществ
- •Определение окисляемости перманганатной
- •Определение окраски
- •Определение запаха
- •Определение прозрачности
- •Определение температуры
- •Определение показателя pH универсальным индикатором
- •Определение аммонийного азота
- •Определение нитритного азота
- •Определение нитратного азота
- •Определение биохимического потребления кислорода
- •Определение количества растворенного кислорода
- •Определение бпк5
- •Определение бихроматной окисляемости ускоренным методом
- •Холостой опыт
- •Определение количества активного хлора
- •Определение нефтепродуктов в сточной воде
- •Уcловия сброса сточных вод в водоемы
- •Выбор технологической схемы очистки сточных вод
- •Обезвоживание и утилизация осадков сточных вод Сгущение осадков
- •Площадки подсушивания
- •Сооружения для обеззараживания, компостирования, термической сушки и сжигания осадка
- •Основные конструкции сушилок
- •Б арабанная сушилка (для мелкокусковых и сыпучих материалов)
- •Сушилка с кипящим слоем
- •Вальцеленточные сушилки
- •Использование осадков сточных вод и активного ила
- •Автономные системы канализации
- •Искусственная очистка сточных вод
- •Литература
- •Приложения Задания к контрольным работам Задание №1
- •Задание №2
- •Задание №3
- •Задание №4
- •Задание №5
- •Задание №7 Рассчитать биологические пруды глубокой очистки
- •Содержание
Определение показателя pH универсальным индикатором
1. Приготовить индикатор, для этого одну ампулу индикатора перенести в колбу, добавить 70 мл этилового спирта и взбол-тать, после чего добавить 30 мл воды, перемешать и нагреть на водяной бане до температуры 40-45°С. Индикатор считается готовым к употреблению.
2. Налить в пробирку 10 мл отстоявшейся исследуемой воды, добавить к ней 3-4 капли универсального индикатора, все взбол-тать и наблюдать за окраской воды в пробирке. Величина pH определяется в зависимости от изменения цвета индикатора, который может быть: pH = 1 - матовый; pH = 2 - розово - оранжевый; pH = 3 - оранжевый; pH = 4 - желто-оранжевый; pH = 5 желтый; pH = 6 - желто - зеленый; pH = 7 - зелено - желтоватый; pH = 8 - зеленый яркий; pH = 9 - сине-зеленый; pH = 10 - синий. При наличии "книжечки" универсального индика-тора необходимо ленточку индикаторной бумаги опустить в исследуемую воду, вынуть и тут же наблюдать изменение цвета бумажки согласно шкале, приложенной к "книжечке".
Определение аммонийного азота
Наличие аммонийного азота в сточной воде указывает на ее содержание фекальными водами. Если сточные воды не содержат промышленных стоков и состоят из бытовых и ливневых стоков, то аммонийный азот можно определять прямым методом без предварительной обработки. При этом необходимо развести испытуемую воду в соотношении 1:10.
1. Приготовить из рабочего стандартного раствора NH4CI шкала растворов с точно заданной концентрацией аммонийного азота, для чего предварительно составить таблицу исходя из условия, что 1 мл стандартного раствора содержит 0,01 мг NH3. Для приготовления растворов в мерные колбы внести указанные в таблице объемы стандартного раствора и каждый объем путем разбавления водой довести до 100 мл.
2. Развести 5 или 10 мл испытуемой воды в мерной колбе до 100 мл.
3.Добавить во все полученные стандартные и испытуемые растворы по 0,5 мл сегнетовой соли и по 1 мл реактива Неслера.
Определение концентрации катиона аммония основано на его реакции с реактивом Несслера с образованием окрашенного в щелочной среде в желтый цвет соединения Hg2OJNH2
![]()
4. Сравнить через 10 мин окраску испытуемой воды с окраской стандартных растворов.
5. Концентрацию аммонийного азота определить по формуле X = a ·n,
где X - концентрация аммонийного азота в испытуемой жидкости, мг/л; а - концентрация аммонийного азота в соответствующей колбе со стандартным раствором, мг/л; n - степень разбавления сточной жидкости.
Пример. Вода разведена в 20 раз. Окраска совпала с колбой N 3. Тогда Х = 0,3 .20 = 6 мг/л.
Определение нитритного азота
Наличие и количество нитритного азота указывает на глубину окислительного процесса, происходящего на биофильтрах. при нагрузке на активный ил биофильтров 400-500 мг/л нитрифи-кация не идет, при 200 - 250 мг/л нитриты появляются только в теплое время года и при 100-150 мг/л нитрификация идет актив-но. Определению нитритов мешают повышенная мутность и взве-шенные вещества. Поэтому из отстоящей сточной воды осторожно отобрать 5 или 10 мл и в мерной колбе развести дистиллированной водой до 100 мл. В этом разведении можно проводить определение нитритов без предварительной обработки.
1. Приготовить из второго рабочего стандартного раствора шкалу растворов с точно заданной концентрацией нитритного азота, для чего предварительно составить таблицу исходя из условия, что 1 мл стандартного раствора содержит 0,0005 мг нитритного азота. Для приготовления растворов в мерные колбы внести указанные в таблице объемы второго стандартного раствора и каждый объем путем разбавления водой довести до 100 мл.
2. Развести 5 или 10 мл испытуемой воды в мерной колбе до 100 мл.
3. Внести во все полученные стандартные испытуемые растворы по 2 мл 12% раствора уксусной кислоты и по 1 мл реактива Грисса. Все взболтать. Нагревать колбы в водяной бане в течение 5 мин при температуре 70°С. При наличии нитритов пробы приобретают розовую окраску.
При этом протекают реакции диазотирования и азосочетания, в результате которых образуется азосоединение (азокраситель), имеющее пурпурную окраску:
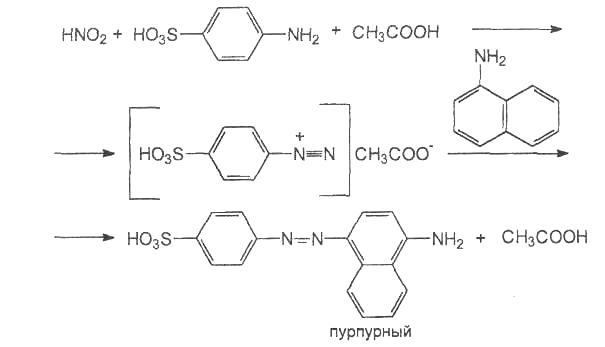
4. Дать раствору остыть и сравнить испытуемую пробу по цвету со стандартным раствором.
5. Определить концентрацию нитритного азота по формуле Х=a•n,
где Х - концентрация нитритного азота в испытуемой жид-кости, мг/л, a - концентрация нитритного азота в стандартном растворе, окраска которого совпала с окраской испытуемой жидкости, мг/л, n - степень разведения испытуемой жидкости.
