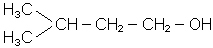- •Загальні правила
- •Запобіжні заходи
- •Перша допомога при нещасних випадках
- •Лабораторна робота 1 методи очистки речовин
- •Перекристалізація
- •Перекристалізація речовин із органічних розчинників
- •Перегонка
- •Перегонка при атмосферному тиску
- •Дробна (фракційна) перегонка
- •Дослід 1.1 Перекристалізація бензойної кислоти
- •Дослід 1.2. Перегонка суміші бензолу і ксилолу
- •Контрольні запитання
- •Лабораторна робота 2 визначення основних фізичних констант органічних речовин
- •1. Визначення температури плавлення
- •2. Визначення температури кипіння
- •3. Визначення густини рідкої речовини
- •Маса води в об’ємі пікнометра при 4 с(х) 1
- •Маса 1 мл води при 4с(х) 1
- •4. Визначення показника заломлюваності
- •Дослід 2.1. Визначення температури плавлення
- •Контрольні запитання
- •Лабораторна робота 3 якісний елементний аналіз органічних сполук
- •Дослід 3.1. Визначення вуглецю пробою на обвуглювання
- •Визначення вуглецю і водню спаленням речовини з оксидом міді (II)
- •Дослід 3.2. Визначення азоту сплавленням речовини з металічним натрієм
- •Хімізм процесу:
- •Дослід 3.3. Визначення сірки сплавленням речовини з металічним натрієм
- •Хімізм процесу:
- •Дослід 3.4. Визначення хлору за зеленим забарвленням полум’я (проба Бельштейна)
- •Хімізм процесу:
- •Контрольні запитання
- •Лабораторна робота 4 насичені вуглеводні Будова, ізомерія, номенклатура, властивості
- •Гомологічний ряд
- •Дослід 4.1. Синтез метану та вивчення його властивостей
- •Хімізм процесу:
- •Хімізм процесу:
- •Реакція метану на бромну воду і перманганат калію
- •Дослід 4.2. Бромування насичених вуглеводнів
- •Хімізм процесу:
- •Окислення парафінів
- •Дослід 4.3. Окислення алканів
- •Контрольні запитання
- •Лабораторна робота 5 алкени Будова, ізомерія, номенклатура, властивості
- •Дослід 5.1. Отримання етилену і його горіння
- •Хімізм процесу:
- •Дослiд 5.2. Приєднання до етилену брому
- •Хiмiзм процесу:
- •Дослiд 5.3. Взаємодiя з окислювачами
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 6
- •Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 6.1. Отримання ацетилену I його горiння.
- •Хiмiзм процесу:
- •Дослiд 6.2. Приєднання брому до ацетилену
- •Хiмiзм процесу:
- •Дослiд 6.3. Реакцiя ацетилену з окислювачами
- •Дослiд 6.4. Утворення ацетиленiду срiбла
- •Хiмiзм процесу:
- •Дослiд 6.5. Утворення ацетиленiду мiдi
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 7 ароматичнi сполуки Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 7.1. Синтез бензолу iз бензойнокислого натрiю
- •Хiмiзм процесу:
- •Дослiд 7.2. Синтез нiтробензолу
- •Хiмiзм процесу:
- •Дослiд 7.3. Дiя бромної води на бензол
- •Дослiд 7.4. Дiя перманганату калiю на бензол
- •Дослiд 7.5. Окислення гомологiв бензолу
- •Контрольнi запитання
- •Лабораторна робота 8 галогенопохiднi вуглеводнi Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 8.1. Синтез хлористого етилу
- •Хiмiзм процесу:
- •Дослiд 8.2. Синтез йодоформу з етилового спирту
- •Дослiд 8.3. Отримання бромбензолу
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 9 спирти I простi ефiри Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 9.1. Утворення I гiдролiз алкоголятiв
- •Хiмiзм процесу:
- •Дослiд 9.2. Окислення етилового спирту оксидом мiдi (II)
- •Хiмiзм процесу:
- •Дослiд 9.3. Окислення етилового спирту перманганатом калiю
- •Хiмiзм процесу:
- •Дослiд 9.4. Синтез дiетилового ефiру
- •Хiмiзм процесу:
- •Дослiд 9.5. Взаємодiя глiцерину з гiдроксидом мiдi (II)
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 10 феноли Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 10.1. Реакцiя фенолу з хлоридом залiза (III)
- •Дослiд 10.2. Отримання трибромфенолу
- •Хiмiзм процесу:
- •Дослiд 10.3. Сульфування фенолу
- •Хiмiзм процесу:
- •Дослiд 10.4. Кольоровi реакцiї багатоатомних фенолiв
- •Контрольнi запитання
- •Лабораторна робота 11 альдегіди і кетони Будова, iзомерiя, номенклатура I властивостi
Хiмiзм процесу:
2Fe + 3Br2 2FeBr3
C6H6
+ Br2
![]() C6H5Br
+ HBr
C6H5Br
+ HBr
бромбензол
Контрольнi запитання
Напишiть структурнi формули можливих галогеналкiлiв складу С4Н9Br (4 iзомери) i назвiть їх за мiжнародною номенклатурою.
Напишiть формули таких сполук: iзопропiлбромiд; йодистий алiл; хлористий вiнiл; 1,1,1-трифтор-2-бром-2-хлоретан (фторотан); 1-хлор-3-йод-3-метилпентан.
Напишiть схеми синтезу 2,2-дихлорпропану: з вiдповiдного ненасиченого вугле-водню; з ацетону.
Перелiчiть реакцiї, за допомогою яких можна перетворити спирт на галогено-похiдне.
Розташуйте в порядку спаду активностi галогену такi галогенопохiднi: хлористий вiнiл, хлористий алiл, хлористий пропiл. Пояснiть рiзну рухомiсть галогену. Вкажiть стрiлками зрушення електронних густин у молекулах цих сполук.
Напишiть схеми реакцiй хлористого iзопропiлу: з металiчним натрiєм (реакцiя Вюрца); з амiаком; з водним розчином лугу; зi спиртовим розчином лугу; з аце-татом натрiю; з етилатом натрiю; з металiчним магнiєм.
Якi змiни виникають при стояннi хлороформу? Напишiть схеми двох послiдовних реакцiй.
Напишiть структурнi формули сполук: 2-хлор-3-метилпентан; 3-хлор-2,2-диметил-гексан; хлористий тетраметилен; 4-бром-4-метилгексан. Якi з них мають цис-транс -iзомери?
Напишiть структурнi формули галогенопохiдних складу С6Н13Br, в яких бром мiститься бiля третинного атома вуглецю. Назвiть їх.
Напишiть рiвняння реакцiй 2,4-дихлор-2-метилбутану зi спиртовим i водним роз-чинами лугу.
Лабораторна робота 9 спирти I простi ефiри Будова, iзомерiя, номенклатура I властивостi
Спирти слiд розглядати як продукти окислення першої стадiї вуглеводнiв або як похiднi вуглеводнiв, в яких один або кiлька водневих атомiв замiщенi на гiдроксили.
Функцiональна група спиртiв ОН-, окси- або гiдроксигрупа, гiдроксил. За кiль-кiстю гiдроксильних груп спирти дiляться на одно- i багатоатомнi, за положенням гiдроксильної групи - на первиннi, вториннi i третиннi - в залежностi вiд того, з яким атомом вуглецю зв’язана ОН-група. Одноатомнi спирти називаються також алкоголятами, двохатомнi - глiколями, трьохатомнi - глiцеринами. Загальна формула одноатомних спиртiв ROH або CnН2n+1OH. Iзомерiя спиртiв залежить вiд iзомерiї вуглецевого ланцюга i положення гiдроксильної групи.
Спирти називають:
- за радикально-функцiональною номенклатурою, додаючи до назви радикала слово спирт (РН);
- беручи за основу метиловий спирт, який ще називають карбiнолом (РН), переважно для вторинних, третинних i розгалужених первинних спиртiв;
- за мiжнародною номенклатурою (МН) до назви основного вуглеводню (з замiщувачами, вказаними перед ним), приєднують закінчення “ол” (останній склад слова алкоголь) вказуючи потiм цифрою положення гiдроксилу у вуглецевому ланцю-гу. Для двохатомних спиртiв використовується закiнчення “дiол”, трьохатомних - “трiол” i т.д. Наприклад:
СН3СН2ОН |
пропанол-2 (МН); |
|
етанол (МН); етиловий спирт (первинний) |
вторинний пропіловий спирт; ізопропіловий спирт; диметилкарбінол |
2,2-диметилпропанол-1(МН); трет-бутилкарбінол |
|
|
3-метилбутанол-1 (МН); ізоаміловий спирт; ізобутилкарбінол |
3-етилпентадіол-2,3 |
Простi ефiри можна розглядати як продукти замiщення водню в гiдроксильнiй групi спирту на який-небудь радикал. Загальна формула ефiру R-O-R‘. За рацiо-нальною номенклатурою називають радикали простих ефiрiв у порядку ускладнення, до останнього радикалу додають закiнчення “овий” i слово “ефiр”. За міжнародною номенклатурою називають радикали простих ефiрiв у порядку ускладнення, до назви другого радикалу ефiру додають закiнчення “окси”, вiдкидаючи закiнчення радикалiв “-ил”:
СН3 – О – СН2СН3 |
|
метилетиловий ефір |
етилізопропіловий ефір; 2-етоксипропан |
Спирти - полярнi сполуки, у метилового спирту = 5,7 10-30 Клм (1,7Д). Спирти мають дуже слабкi кислi властивостi, слабшi, нiж у води. Вони не забарвлюють лакмус у червоний колiр, практично не взаємодiють з водними розчинами лугiв, однак з лужними металами дають алкоголяти, якi легко розчиняються водою. Спирти можна розглядати i як дуже слабкi основи, тому що вони можуть протонiзуватися за рахунок неподiленої електронної пари атома кисню i, таким чином, утворювати оксонiєвi солi. Практично протонiзацiю з утворенням немiцного оксонiєвого катiона доводиться враховувати як промiжну стадiю реакцiї спиртiв у кислому середовищi. Взагалi спирти можна назвати нейтральними сполуками (особливо на вiдмiну вiд фенолiв, яким ОН-група надає кислого характеру).
Для IЧ-спектрiв спиртiв особливо притаманна смуга поглинання при 3300- 2700 см-1 (валентнi коливання ОН). Крiм того, iснують смуги при 1400-1250 см-1 (де-формацiйнi коливання ОН) i 1200-1000 см-1 (валентнi коливання С-О). Остання область поглинання спостерiгається i у простих ефiрiв.
З хiмiчних властивостей спиртiв найбiльш важлива взаємодiя з лужними металами, спиртами з утворенням простих ефiрiв i кислотами з утворенням складних ефiрiв. Молекули простих ефiрiв також мають деякий невеликий електричний момент диполя (метиловий ефiр = 4,3 10-30 Клм; (1,3Д), дiетиловий ефiр - = 3,910-30 Кл м (1,18Д), вони iнертнi до рiзних реагентiв, - наприклад, не реагують на холодi з металiчним натрiєм, - i тому часто використовуються як розчинники при проведеннi хiмiчних реакцiй. Простi ефiри можуть все ж розкладатися при звичайнiй температурi під дiєю йодистого алкiлу.