
- •Загальні правила
- •Запобіжні заходи
- •Перша допомога при нещасних випадках
- •Лабораторна робота 1 методи очистки речовин
- •Перекристалізація
- •Перекристалізація речовин із органічних розчинників
- •Перегонка
- •Перегонка при атмосферному тиску
- •Дробна (фракційна) перегонка
- •Дослід 1.1 Перекристалізація бензойної кислоти
- •Дослід 1.2. Перегонка суміші бензолу і ксилолу
- •Контрольні запитання
- •Лабораторна робота 2 визначення основних фізичних констант органічних речовин
- •1. Визначення температури плавлення
- •2. Визначення температури кипіння
- •3. Визначення густини рідкої речовини
- •Маса води в об’ємі пікнометра при 4 с(х) 1
- •Маса 1 мл води при 4с(х) 1
- •4. Визначення показника заломлюваності
- •Дослід 2.1. Визначення температури плавлення
- •Контрольні запитання
- •Лабораторна робота 3 якісний елементний аналіз органічних сполук
- •Дослід 3.1. Визначення вуглецю пробою на обвуглювання
- •Визначення вуглецю і водню спаленням речовини з оксидом міді (II)
- •Дослід 3.2. Визначення азоту сплавленням речовини з металічним натрієм
- •Хімізм процесу:
- •Дослід 3.3. Визначення сірки сплавленням речовини з металічним натрієм
- •Хімізм процесу:
- •Дослід 3.4. Визначення хлору за зеленим забарвленням полум’я (проба Бельштейна)
- •Хімізм процесу:
- •Контрольні запитання
- •Лабораторна робота 4 насичені вуглеводні Будова, ізомерія, номенклатура, властивості
- •Гомологічний ряд
- •Дослід 4.1. Синтез метану та вивчення його властивостей
- •Хімізм процесу:
- •Хімізм процесу:
- •Реакція метану на бромну воду і перманганат калію
- •Дослід 4.2. Бромування насичених вуглеводнів
- •Хімізм процесу:
- •Окислення парафінів
- •Дослід 4.3. Окислення алканів
- •Контрольні запитання
- •Лабораторна робота 5 алкени Будова, ізомерія, номенклатура, властивості
- •Дослід 5.1. Отримання етилену і його горіння
- •Хімізм процесу:
- •Дослiд 5.2. Приєднання до етилену брому
- •Хiмiзм процесу:
- •Дослiд 5.3. Взаємодiя з окислювачами
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 6
- •Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 6.1. Отримання ацетилену I його горiння.
- •Хiмiзм процесу:
- •Дослiд 6.2. Приєднання брому до ацетилену
- •Хiмiзм процесу:
- •Дослiд 6.3. Реакцiя ацетилену з окислювачами
- •Дослiд 6.4. Утворення ацетиленiду срiбла
- •Хiмiзм процесу:
- •Дослiд 6.5. Утворення ацетиленiду мiдi
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 7 ароматичнi сполуки Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 7.1. Синтез бензолу iз бензойнокислого натрiю
- •Хiмiзм процесу:
- •Дослiд 7.2. Синтез нiтробензолу
- •Хiмiзм процесу:
- •Дослiд 7.3. Дiя бромної води на бензол
- •Дослiд 7.4. Дiя перманганату калiю на бензол
- •Дослiд 7.5. Окислення гомологiв бензолу
- •Контрольнi запитання
- •Лабораторна робота 8 галогенопохiднi вуглеводнi Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 8.1. Синтез хлористого етилу
- •Хiмiзм процесу:
- •Дослiд 8.2. Синтез йодоформу з етилового спирту
- •Дослiд 8.3. Отримання бромбензолу
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 9 спирти I простi ефiри Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 9.1. Утворення I гiдролiз алкоголятiв
- •Хiмiзм процесу:
- •Дослiд 9.2. Окислення етилового спирту оксидом мiдi (II)
- •Хiмiзм процесу:
- •Дослiд 9.3. Окислення етилового спирту перманганатом калiю
- •Хiмiзм процесу:
- •Дослiд 9.4. Синтез дiетилового ефiру
- •Хiмiзм процесу:
- •Дослiд 9.5. Взаємодiя глiцерину з гiдроксидом мiдi (II)
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 10 феноли Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 10.1. Реакцiя фенолу з хлоридом залiза (III)
- •Дослiд 10.2. Отримання трибромфенолу
- •Хiмiзм процесу:
- •Дослiд 10.3. Сульфування фенолу
- •Хiмiзм процесу:
- •Дослiд 10.4. Кольоровi реакцiї багатоатомних фенолiв
- •Контрольнi запитання
- •Лабораторна робота 11 альдегіди і кетони Будова, iзомерiя, номенклатура I властивостi
Дослiд 7.5. Окислення гомологiв бензолу
Реактиви та матеріали: |
толуол, перманганат калiю (0,1Н розчин), сiрчана кислота (2Н розчин) |
Обладнання: |
пробiрки, пiпетка |
В пробiрку вiдбирають пiпеткою 3 краплi води, краплю розчину перманганату калiю i краплю розчину сiрчаної кислоти. Потiм додають краплю толуолу i енергiйно струшують протягом 1-2 хв. Рожеве забарвлення поступово зникає, i розчин знебар-влюється.
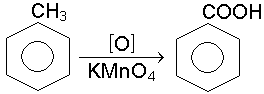
толуол бензойна кислота
Контрольнi запитання
Вкажiть, як можна розрiзнити гексан, гексен i бензол. Напишiть рiвняння реакцiй.
Як можна розрiзнити: бензол i толуол; бензол i нiтробензол?
Напишiть структурнi формули сполук: етилбензол; толуол; стирол; о-хлор-нiтро-бензол; п-толуолсульфокислота (п-сульфокислота); хлорбензол; 1-хлор-2-нiтро-4-сульфобензол.
Назвiть сполуки:





Напишiть формули двох сполук, якщо при їх окисленнi отримали: з однiєї - бензойну кислоту, з другої - п-C6H4(COOH)2.
Лабораторна робота 8 галогенопохiднi вуглеводнi Будова, iзомерiя, номенклатура I властивостi
Галогенопохiднi - продукти замiщення атомiв водню у вуглеводнях на атоми галогену (один або декiлька).
За кiлькiстю атомiв галогену в молекулi вони дiляться на моно-, ди-, три- i бiльше галогенопохiднi. Моногалогенопохiднi називають часто галогеналкiлами. За розташуванням атома галогену у вуглецевому ланцюзi вони подiляються на первиннi, вториннi i третиннi. Якщо атом галогену приєднується до вуглецю, що в свою чергу з’єднується тiльки з одним вуглецем, то галогенопохiдне називається первинним. Якщо галоген проєднується до вуглецю, зв’язаного з двома iншими атомами вуглецю, галогенопохiдне називають вторинним. Якщо галоген стоїть бiля третинного атома вуглецю, галогенопохiдне називають третинним. Наприклад:
СН3 СН2 СН2Сl первинний хлористий |
|
|
пропіл |
вторинний |
третинний |
Галогенопохiднi вуглеводнi називають за номенклатурами:
- тривiальною, або емпiричною, випадковою, яка не вказує на стуктуру сполуки (хлороформ СНСl3, фторотан CF3CHClBr);
- рацiональною, або радикально-функцiональною - називають вуглеводний радикал i галоген (хлористий етил C2H5Cl, хлористий вiнiл або вiнiлхлорид CH2=CHCl);
- мiжнародною - нумерують найдовший нерозгалужений ланцюг атомiв вуг-лецю, починаючи з боку ближчого до галогену, вказують цифрою його положення, називають галоген, потiм називають основний вуглеводень, наприклад:
|
|
2-хлорбутан |
2-бром-3-метилбутан |
В IЧ-спектрi смуга поглинання при 800-600 см-1 характерна для хлорпохiдних, а при 600-500 см-1 для бром- i йодопохiдних. Галогенопохiднi через бiльшу електро-негативнiсть атомiв галогену є сполуками полярними i, отже, реакцiйноздатними. Галоген у них рухомий, легко замiщується на iншi атоми i групи атомiв. Проте, якщо галоген стоїть бiля вуглецю, зв’язаного подвiйним зв’язком, наприклад СН2=СНСl, то внаслiдок спряження неподiленої електронної пари з близько розташованими -електронами подвiйного зв’язку рухомiсть атомiв галогену зменшується. В сполуках типу хлористого алiлу CH2=CHCH2Cl рухомiсть галогену збiльшена, тому що такi сполуки в процесi реакцiї дуже легко утворюють iон галогену i карбокатiон, заряд алiлкатiону стабiлiзується частковою компенсацiєю позитивного заряду сусiднiми електронами подвiйного зв’язку:
![]() або
або
![]()
Реакцiї замiщення галогенiв у галогенопохiдних належать до реакцiй нуклео-фiльного замiщення:
1. SN2 - механiзм замiщення бiмолекулярний, одностадiйний. Характерний для первинних галогеналкiлiв. Вiдбувається з утворенням нестiйкого промiжного стану або активного комплексу:
R X + Y Y+ … R … X+ R Y + X ;
2. SN1 - механiзм замiщення мономолекулярний, двохстадiйний. Характерний для третинних галогеналкiлiв i сполук алiльного типу, якi легко дисоцiюють на iони. Загальна схема:
a)
RX
![]() R+
+ X
; б)
R+
+ Y
R+
+ X
; б)
R+
+ Y
![]() RY
RY
Перша стадiя бiльш повiльна, визначає швидкiсть реакцiї замiщення.
Галогенування ароматичних вуглеводнiв вiдбувається за механiзмом електро-фiльного замiщення SE2аром. В ролi каталiзаторiв застосовують кислоти Льюiса, найчастiше галогенiди залiза та алюмiнiю. Наприклад, хлорування бензолу може бути зображено такою схемою:

Галогенування гомологiв бензолу на свiтлi i при нагрiваннi супроводжується замiщенням водню в боковому ланцюзi (радикально-ланцюговий механiзм), у присут-ностi кислот Льюiса - в ядрi (механiзм SE2 аром).

Фуран, пiрол, тiофен галогенуються легше бензолу, а пiридин - важче. В ре-зультатi прямого галогенування отримують сумiш продуктiв замiщення.




