
- •Факультет «Инженерные технологии»
- •Утверждаю:
- •131000.62 Нефтегазовое дело
- •I Реакционная способность веществ
- •Типы гибридизации, геометрическая форма частиц
- •2 Ионная связь
- •3 Металлическая связь
- •1. Вандерваальсовы силы
- •2. Водородная связь
- •3, Комплексные соединения
- •II Общие закономерности химических процессов
- •III Растворы. Окислительно-восстановительные процессы
- •1. Реакции, идущие с образованием слабых электролитов
- •2. Реакции, идущие с образованием газообразного вещества
- •3. Реакции, идущие с образованием труднорастворимого вещества
- •IV Избранные вопросы неорганической химии классы неорганических соединений
- •Кислоты
- •Основания
- •Неметаллы
- •Химия s- и p-металлов
- •Химия d-элементов
- •V Элементы органической химии Общая характеристика органических соединений
- •Классификация органических соединений
- •Классы органических соединений
- •Классификация органических реакций
- •Номенклатура и изомерия органических соединений
- •Углеводороды Насыщенные (предельные) углеводороды (алканы)
- •Некоторые способы получения алканов
- •Алициклические соединения (нафтены)
- •Номенклатура, изомерия
- •Некоторые способы получения циклоалканов
- •Основные реакции алициклических углеводородов
- •Ненасыщенные (непредельные) углеводороды ряда этилена (алкены)
- •Номенклатура и изомерия
- •Некоторые способы получения этиленовых углеводородов
- •Непредельные ненасыщенные углеводороды ряда ацетилена (алкины)
- •Номенклатура и изомерия
- •Основные реакции ацетиленовых углеводородов
- •Ароматические углеводороды (арены)
- •Номенклатура и изомерия
- •Некоторые способы получения ароматических углеводородов
- •VI Высокомолекулярные органические соединения
- •Классификация полимеров
- •Методы получения
- •Ионная полимеризация
- •Процессы поликонденсации
- •Строение полимеров
- •Биополимеры
- •Каучуки
- •Вопросы для подготовки к экзамену
- •Список литературы
- •Приложения
- •Термодинамические характеристики некоторых веществ
- •Константы нестойкости комплексных ионов
- •Произведения растворимости труднорастворимых веществ (при комнатной температуре)
- •Растворимость солей, кислот и оснований в воде
1. Реакции, идущие с образованием слабых электролитов
Примером данного типа реакций является реакция нейтрализации. Процесс взаимодействия основания с кислотой, приводящий к образованию соли и воды, называется реакцией нейтрализации.
KOH + HNO3 = KNO3 + H2O
OH- + H+ = H2O
2. Реакции, идущие с образованием газообразного вещества
К данному типу реакций относятся в основном реакции, сопровождающиеся выделением водородных соединений неметаллов H2S, HF, HCl, HI, NH3 и др., например
ZnS + 2HCl = ZnCl2 + H2S↑
или в ионном виде:
ZnS + 2H+ = Zn2+ + H2S↑
Поскольку сульфид цинка плохо растворим в воде, то в ионном уравнении реакции эту соль записывают в молекулярной форме.
3. Реакции, идущие с образованием труднорастворимого вещества
Значительно чаще происходят реакции, сопровождающиеся образованием труднорастворимых веществ, которые удаляются из сферы реакции в виде осадка, например:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
или ионное уравнение реакции:
Сa2+
+ CO![]() =CaCO3↓
=CaCO3↓
Малорастворимые электролиты. Важной количественной характеристикой растворов является растворимость Ср. Она численно равна концентрации насыщенного раствора при данной температуре и выражается в г растворённого вещества на 100 г растворителя или в моль/л.
В насыщенных растворах малорастворимых сильных электролитов произведение активностей ионов этих электролитов в степенях их стехиометрических коэффициентов есть величина постоянная для данной температуры и называется произведением растворимости ПР. В случае разбавленных растворов электролитов можно принять величину активности практически равной величине концентрации. Тогда для электролита
АnBm → nAm+ + mBn-.
ПР = [nAm+]n[mBn-]m.
Растворимость вещества С р связана с ПР соотношением:
Ср
=
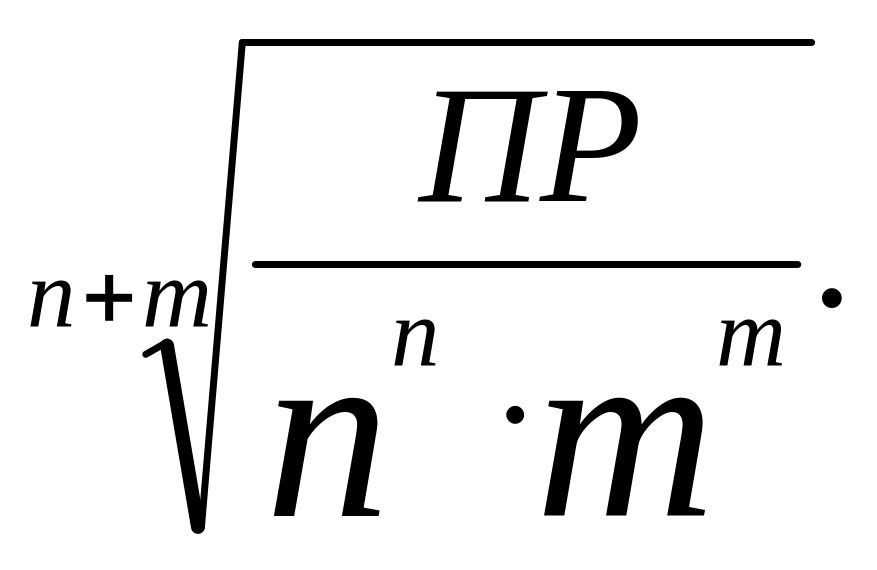
Таким образом, зная ПР, можно рассчитать растворимость и наоборот. Используя справочные величины ПР (табл. 3 Приложения), можно определить, возможно ли приготовить раствор заданной концентрации.
Пример 20. Произведение растворимости иодида свинца при 20С равно 8∙10-9. Вычислить растворимость соли (в моль/л и г/л) при указанной температуре.
Р е ш е н и е. Обозначим искомую растворимость через s (моль/л). Тогда в насыщенном растворе PbI2 содержится s моль/л ионов Pb2+ и 2s моль/л ионов I-. Отсюда:
ПРPbI2 = [Pb2+][ I-]2 = s(2s)2 = 4s3
и
s =
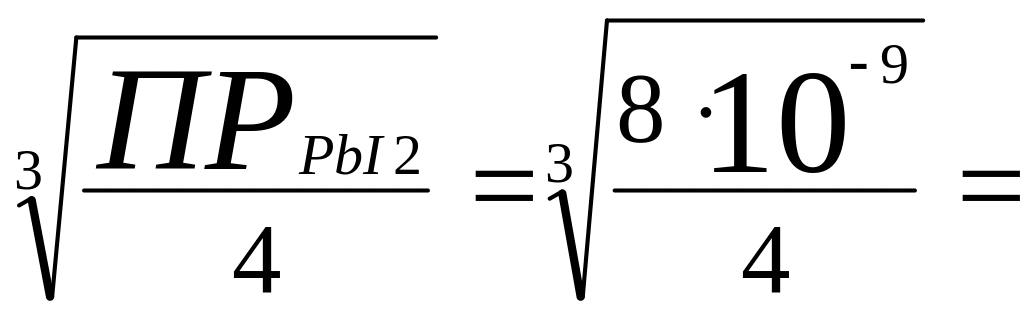 1,3
10-3
моль/л.
1,3
10-3
моль/л.
Поскольку мольная масса PbI2 равна 461 г/моль, то растворимость PbI2, выраженная в г/л, составит 1,3∙10-3 ∙461 = 0,6 г/л.
В химически чистой воде концентрация ионов водорода и гидроксид-ионов одинакова, поэтому вода имеет нейтральную реакцию (рН=7). При растворении многих солей в воде их ионы, образующиеся в результате диссоциации, вступают во взаимодействие с ионами воды, при этом происходит связывание ионов H+ или OH- ионами соли с образованием малодиссоциирующих соединений.
Процесс взаимодействия ионов растворенной соли с водой, приводящий к образованию слабых электролитов, называется гидролизом соли.
В результате гидролиза смещается равновесие электролитической диссоциации воды: Н2О ↔ Н+ + ОН-, поэтому растворы большинства солей имеют кислую или щелочную реакцию. различают три случая гидролиза солей:
1. Соли, образованные сильным основанием и слабой кислотой (например, KCN, K2SO3, CH3COONa, Na2S и др.). Гидролиз этих солей обусловлен связыванием ионов водорода в слабый электролит. Например, гидролиз ацетата натрия можно записать в виде следующего молекулярного уравнения:
CH3COONa + Н2О ↔ CH3COOН + NaOH
Или в ионном виде:
CH3COO- + НОН ↔ CH3COOН + ОН- (рН > 7)
Соли, образованные сильным основанием и многоосновной кислотой, гидролизуются ступенчато, с образованием кислых солей; например, гидролиз карбоната калия.
Первая ступень:
К2СО3 + Н2О ↔ КНСО3 + КОН
СО
+ НОН ↔ НСО![]() + ОН-
(рН >
7)
+ ОН-
(рН >
7)
Вторая ступень:
КНСО3 + Н2О ↔ Н2СО3 + КОН
НСО + НОН ↔ Н2СО3 + ОН- (рН > 7)
Более сильно выражен гидролиз по первой ступени.
Растворы солей, образованных сильным основанием и слабой кислотой, имеют щелочную реакцию вследствие гидролиза (рН > 7).
2. Соли, образованные слабым основанием и сильной кислотой (например, NH4Cl, CuSO4, ZnCl2 и др.). Гидролиз этих солей обусловлен связыванием гидроксид-ионов воды в слабый электролит.
В результате
гидролиза хлорида аммония ионы ОН-
связываются ионами NH![]() в малодиссоциированные молекулы NH4OH,
при этом в растворе накапливается
избыток ионов водорода, и реакция
раствора становится кислой (рН <
7):
в малодиссоциированные молекулы NH4OH,
при этом в растворе накапливается
избыток ионов водорода, и реакция
раствора становится кислой (рН <
7):
NH4Cl + Н2О ↔ NH4OH + HCl
NH + НОН ↔ NH4OH + H+ (рН < 7)
Если соль образована многозарядным катионом, то гидролиз протекает ступенчато, с образованием основных солей.
Растворы солей, образованные слабым основанием и сильной кислотой, имеют кислую реакцию вследствие гидролиза (рН < 7).
3. Соли, образованные слабой кислотой и слабым основанием. Соли такого типа гидролизуются в наиболее высокой степени, так как их ионы одновременно связывают ионы водорода и гидроксид-ионы воды, сдвигая равновесие диссоциации воды. Например, гидролиз ацетата аммония можно представить следующим уравнением:
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
или в ионном виде:
CH3COO- + NH + HOH ↔ CH3COOH + NH4OH
В зависимости от соотношения констант диссоциации, образующихся в результате гидролиза кислоты и основания, растворы солей этого типа могут иметь слабокислую или слабощелочную реакцию, т.е. рН близко к 7.
Различают две группы химических реакций: реакции, протекающие без изменения степени окисления, и реакции, протекающие с изменением степени окисления атомов элементов.
Реакции, идущие с изменением степени окисления, называют окислительно-восстановительными.
Вещества, атомы или ионы которого повышают свою степень окисления, называются восстановителями.
Вещества, атомы или ионы которого понижают свою степень окисления, называются окислителями.
Окисление невозможно без протекающего одновременно с ним восстановления, и наоборот, восстановление одного вещества невозможно без одновременного окисления другого вещества.
Восстановителями могут быть:
а) нейтральные атомы всех элементов, кроме фтора и некоторых инертных газов;
б) атомы неметаллов в отрицательной степени окисления;
в) атомы элементов в промежуточной положительной степени окисления.
Окислителями могут быть:
а) нейтральные атомы неметаллов;
б) атомы элементов в промежуточной положительной степени окисления;
в) атомы элементов в высшей положительной степени окисления.
Для составления уравнений реакций окисления-восстановления необходимо знать формулы веществ, участвующих и получающихся в результате реакции.
Используют два метода составления уравнений реакций окисления-восстановления: метод электронного баланса и метод ионно-электронный. Для удобства при составлении уравнений окислительно-восстановительных реакций принимают, что происходит не перераспределение электронной плотности, а прием и отдача электронов.
В методе электронного баланса подсчет числа присоединенных и теряемых электронов производится на основании сравнения величин степеней окисления атомов элементов до и после реакции.
Пример 21. Составить уравнение реакции между бромоводородом и концентрированным раствором серной кислоты. В результате реакции образуется свободный бром и оксид серы (IV).
1. Записываем схему реакции:
HBr + H2SO4 → Br2 + SO2
2. Определяем степень окисления атомов элементов до и после реакции. Выясняем, что произошло изменение степени окисления брома и серы:
HBr-
+ H2![]() O4
→
O4
→
![]() +
+
![]() O2
O2
3. Составляем электронное уравнение:
![]() -
1
-
1![]() →
→
![]()
+ 2 →
4. Подбираем коэффициенты для окислителя и восстановителя. Так как общее число электронов, отданных восстановителем, должно быть равным числу электронов, принятых окислителем, то на каждый атом должно приходиться два иона брома :

- 1 → 2
2
+ 2 → 1
5. Найденные коэффициенты подставляем в схему реакции:
2HBr + H2SO4 → Br2 + SO2
6. Сравнение обеих частей уравнения показывает, что в левой части находятся четыре атома водорода и два атома кислорода, которых нет в правой части уравнения.
Составляем уравнение реакции в окончательном виде:
2HBr + H2SO4 → Br2 + SO2 + 2Н2О
7. В заключении проверяем правильность уравнения, подсчитывая и сравнивая числа атомов кислорода в обеих частях уравнения.
При составлении уравнений окислительно-восстановительных реакций, протекающих в растворах, часто применяют ионно-электронный метод (метод полуреакций). В его основе лежит составление ионных уравнений для процесса окисления и процесса восстановления(частные уравнения) и последующее суммирование их в общее уравнение. при составлении ионной схемы используют правила составления кратких ионных уравнений: формулы сильных электролитов записывают в виде ионов, а слабых электролитов, осадков и газов – в виде молекул; ионы, не претерпевшие изменения в результате реакции, в схему не вносят.
Пример 22. Реакция окисления иодида калия в кислой среде с помощью перманганата калия выражается схемой:
KMnO4 + KI + H2SO4 → MnSO4 + I2 + K2SO4 + H2O
1. Записываем уравнение этой реакции в виде краткого ионного уравнения:
MnO![]() + I-
+ H+
→ Mn2+
+ I2
+ H2O
+ I-
+ H+
→ Mn2+
+ I2
+ H2O
2. Из уравнения следует, что перманганат-ион восстанавливается до иона Mn2+. В кислом растворе атомы кислорода, входящие в состав ионов MnO , вместе с ионами водорода образуют молекулы воды.
В правильно написанном уравнении полуреакции отражается неизменность как числа атомов, так и числа электрических зарядов в исходных веществах и продуктах реакции, т.е. материальный и электронный баланс. Уравнение полуреакции после расстановки коэффициентов имеет следующий вид:
MnO + 8H+ → Mn2+ + 4H2O
окисленная восстановленная
форма форма
3. Необходимо, чтобы в полуреакции восстановления MnO равенство существовало ещё и по зарядам. Алгебраическая сумма зарядов ионов слева составляет +7, а справа - +2. Поэтому к левой части уравнения добавляем 5 :
MnO + 8H+ + 5 → Mn2+ + 4H2O
4. Полуреакция окисления ионов иода имеет вид:
I- → I2
5. Для уравнивания зарядов необходимо от левой части схемы отнять 2 :
I- - 2 → I2
восстанов- окисленная
ленная форма форма
6. Суммируем уравнения обеих полуреакций в общее уравнение:
MnO + 8H+ + 5 → Mn2+ + 4H2O
I- - 2 → I2
7. Поставим соответствующие коэффициенты перед окислителем и восстановителем
2MnO + 10I- + 16H+ → 2Mn2+ + 5I2 + 8H2O
и составляем уравнение окислительно-восстановительного процесса в молекулярной форме, учитывая, что серная кислота взята в качестве среды:
2KMnO4 + 10KI + 8H2SO4 → 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Задание
11. Из четырёх веществ вашего варианта выберите сильные и слабые электролиты и составьте уравнения диссоциации их в водном растворе.
12. Рассчитайте величину рН и рОН раствора, зная величину концентрации Н+ ионов (столбец 5).
13. В столбце 3 приведены малорастворимые электролиты. Напишите выражение ПР малорастворимого электролита вашего варианта. Определите, в каком объёме воды можно растворить 0,5 г данного малорастворимого вещества.
Номер варианта |
Наименование веществ |
Наименование веществ |
[H+], моль/л |
||
1 |
2 |
3 |
4 |
5 |
|
1 |
CsOH |
H2C2O4 |
SrSO4 |
Na2SO3 |
10-4 |
2 |
Sr(OH)2 |
H3BO3 |
MnS |
K2S |
3,2∙10-6 |
3 |
RbOH |
CH3COOH |
PbI2 |
Al2(SO4)3 |
7,4∙10-11 |
4 |
H2SO4 |
NH4OH |
BaCrO4 |
NaNO2 |
10-3 |
5 |
LiOH |
H3PO4 |
Ca3(PO4)2 |
HCOOLi |
6,5∙10-8 |
6 |
HI |
H2SO3 |
CaCO3 |
Na2SiO3 |
1,4∙10-12 |
7 |
Ba(OH)2 |
HCN |
CaSO4 |
K2SO3 |
2∙10-7 |
8 |
HClO4 |
NH4OH |
MgCO3 |
(NH4)2SO4 |
8,1∙10-3 |
9 |
HCl |
H2Se |
Ag2SO4 |
Na2CO3 |
2,7∙10-10 |
10 |
NaOH |
H2SiO3 |
BaSO4 |
FeCl2 |
4,6∙10-4 |
Вариант 1.
14. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов:
а) Pb(NO3)2 + KI; б) NiCl2 + H2S
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
AgNO3→Ag + NO2 + O2
б) ионно-электронным методом:
KClO3 + FeSO4 + H2SO4 = KCl + Fe2(SO4)3 + H2O
Вариант 2.
14. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов:
а) K2CO3 + HCl; б) CuSO4 + NaOH
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
P + KOH + H2O → PH3 + KH2PO4
б) ионно-электронным методом:
NaNO3 + NaI + H2SO4 = NO + I2 + Na2SO4 + H2O
Вариант 3.
14. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов:
а) CaCO3 + HCl; б) CuSO4 + Na2S
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
HClO3 = ClO2 + HClO4
б) ионно-электронным методом:
K2SO3 + KMnO4 + H2O = K2SO4 + MnO2 + KOH
Вариант 4.
14. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений:
а) Na2S + H2SO4; б) FeS + HCl
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
H2S + H2SO3 = S + H2O
б) ионно-электронным методом:
As2S3 + HNO3 = H3AsO4 + H2SO4 + NO
Вариант 5.
14. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений:
а) HCOOK + HNO3; б) NH4Cl + Ca(OH)2
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
Zn + HNO3(разб) = Zn(NO3)2 + N2 + H2O
б) ионно-электронным методом:
FeCl2 + KMnO4 + HCl(разб) = FeCl3 + MnCl2 + KCl + H2O
Вариант 6.
14. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений:
а) NaClO + HNO3; б) KCN + HCl
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
FeCl3 + H2S = FeCl2 + S + HCl
б) ионно-электронным методом:
HNO2 + KMnO4 + H2SO4 = HNO3 + MnSO4 + K2SO4 + H2O
Вариант 7.
14. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов:
а) Pb(NO3)2 + KI; б) NiCl2 + H2S; в) K2CO3 + HCl;
г) CuSO4 + NaOH; д) CaCO3 + HCl.
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
SO2 + Br2 + H2O = HBr + H2SO4;
б) ионно-электронным методом:
AgNO3 + KOH + H2O2= Ag + KNO3 + O2
Вариант 8.
14. Написать в ионно-молекулярной форме уравнения взаимодействия между водными растворами следующих веществ:
а) NaHCO3 и HCl; б) FeCl3 и KOH;
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
Cu + H2SO4 = CuSO4 + SO2 + H2O
б) ионно-электронным методом:
KMnO4 + MnSO4 + H2O = MnO2 + K2SO4 + H2SO4
Вариант 9.
14. Написать в ионно-молекулярной форме уравнения взаимодействия между водными растворами следующих веществ:
a) Pb(CH3COO)2 и Na2S; б) KHS и H2SO4;
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
HCl + CrO3 = CrCl3 + Cl2 + H2O
б) ионно-электронным методом:
KMnO4 + KOH = K2MnO4 + O2 + H2O
Вариант 10.
14. Написать в ионно-молекулярной форме уравнения взаимодействия между водными растворами следующих веществ:
а) Ca(OH)2 и CO2; б) Fe(OH)3 и HCl
15. Расставить коэффициенты в окислительно-восстановительных реакциях:
а) методом электронного баланса:
I2 + KOH = KIO3 + KI + H2O
б) ионно-электронным методом:
K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O
