
- •Факультет «Инженерные технологии»
- •Утверждаю:
- •131000.62 Нефтегазовое дело
- •I Реакционная способность веществ
- •Типы гибридизации, геометрическая форма частиц
- •2 Ионная связь
- •3 Металлическая связь
- •1. Вандерваальсовы силы
- •2. Водородная связь
- •3, Комплексные соединения
- •II Общие закономерности химических процессов
- •III Растворы. Окислительно-восстановительные процессы
- •1. Реакции, идущие с образованием слабых электролитов
- •2. Реакции, идущие с образованием газообразного вещества
- •3. Реакции, идущие с образованием труднорастворимого вещества
- •IV Избранные вопросы неорганической химии классы неорганических соединений
- •Кислоты
- •Основания
- •Неметаллы
- •Химия s- и p-металлов
- •Химия d-элементов
- •V Элементы органической химии Общая характеристика органических соединений
- •Классификация органических соединений
- •Классы органических соединений
- •Классификация органических реакций
- •Номенклатура и изомерия органических соединений
- •Углеводороды Насыщенные (предельные) углеводороды (алканы)
- •Некоторые способы получения алканов
- •Алициклические соединения (нафтены)
- •Номенклатура, изомерия
- •Некоторые способы получения циклоалканов
- •Основные реакции алициклических углеводородов
- •Ненасыщенные (непредельные) углеводороды ряда этилена (алкены)
- •Номенклатура и изомерия
- •Некоторые способы получения этиленовых углеводородов
- •Непредельные ненасыщенные углеводороды ряда ацетилена (алкины)
- •Номенклатура и изомерия
- •Основные реакции ацетиленовых углеводородов
- •Ароматические углеводороды (арены)
- •Номенклатура и изомерия
- •Некоторые способы получения ароматических углеводородов
- •VI Высокомолекулярные органические соединения
- •Классификация полимеров
- •Методы получения
- •Ионная полимеризация
- •Процессы поликонденсации
- •Строение полимеров
- •Биополимеры
- •Каучуки
- •Вопросы для подготовки к экзамену
- •Список литературы
- •Приложения
- •Термодинамические характеристики некоторых веществ
- •Константы нестойкости комплексных ионов
- •Произведения растворимости труднорастворимых веществ (при комнатной температуре)
- •Растворимость солей, кислот и оснований в воде
Типы гибридизации, геометрическая форма частиц
и углы между связями
Гибридизация |
Геометрическая форма |
Угол между связями |
sp |
линейная (BeH2) |
180о |
sp2 |
треугольная (BF3) |
120о |
sp3 |
тетраэдрическая (NH4+) |
109о28/ |
sp3d |
тригонально-бипирамидальная (SF4) |
90о,120о |
sp3d2 |
октаэдрическая (SF6) |
90о |
Типы связи. Ковалентная связь, образованная однократным перекрыванием электронных облаков по линии, соединяющей центры взаимодействующих атомов, называется σ-связью. Связь, образованная перекрыванием атомных орбиталей по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью.
Поляризуемостью связи называется способность связи становиться полярной или более полярной в результате действия внешнего электрического поля.
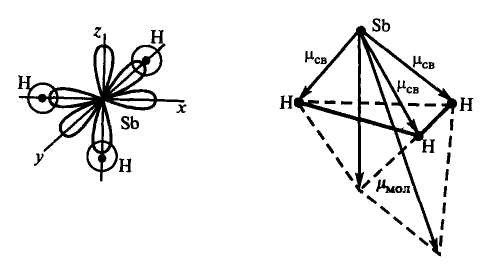
Пример 6. Определите пространственную структуру молекул SbH3 и BH3 и их полярность.
Р е ш е н и е. Связи в молекуле SbH3 образуются перекрыванием трёх р-орбиталей атома сурьмы (5s25p3) с тремя s-орбиталями трёх атомов водорода (1s1). Поскольку 3p-облака ориентированы в трёх взаимно перпендикулярных направлениях (по осям x,y,z), то связи в образовавшейся молекуле SbH3 направлены от вершины тригональной пирамиды, в которой находится атом сурьмы, к её основанию, в вершинах которого находятся атомы водорода. Следовательно, молекула SbH3 имеет
пирамидальную структуру.
Сумма векторов моментов диполей всех связей в молекуле SbH3 не равна нулю, и следовательно, молекула в целом полярна.
2 Ионная связь
Ионная связь образуется между атомами, сильно отличающимися друг от друга величиной электроотрицательности. Такая связь обусловлена электростатическим взаимодействием отрицательно и положительно заряженных ионов в химическом соединении.
Так как электрическое поле имеет сферический характер, то для ионной связи характерна ненасыщенность и ненаправленность. Чисто ионной связи не существует, говорят лишь о доле ионности связи.
3 Металлическая связь
Это химическая связь в металлах, где небольшое число электронов связывает большое число ядер атомов, а сами электроны могут перемещаться в металле. Таким образом, в металлах нелокализованная химическая связь. Это обусловливает их высокую электро- и теплопроводность, металлический блеск и др.
При сближении молекул появляется притяжение, что влечет за собой образование конденсированного (жидкого или твердого) состояния вещества. К основным видам межмолекулярного взаимодействия относятся вандерваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
