- •Факультет «Инженерные технологии»
- •Утверждаю:
- •131000.62 Нефтегазовое дело
- •I Реакционная способность веществ
- •Типы гибридизации, геометрическая форма частиц
- •2 Ионная связь
- •3 Металлическая связь
- •1. Вандерваальсовы силы
- •2. Водородная связь
- •3, Комплексные соединения
- •II Общие закономерности химических процессов
- •III Растворы. Окислительно-восстановительные процессы
- •1. Реакции, идущие с образованием слабых электролитов
- •2. Реакции, идущие с образованием газообразного вещества
- •3. Реакции, идущие с образованием труднорастворимого вещества
- •IV Избранные вопросы неорганической химии классы неорганических соединений
- •Кислоты
- •Основания
- •Неметаллы
- •Химия s- и p-металлов
- •Химия d-элементов
- •V Элементы органической химии Общая характеристика органических соединений
- •Классификация органических соединений
- •Классы органических соединений
- •Классификация органических реакций
- •Номенклатура и изомерия органических соединений
- •Углеводороды Насыщенные (предельные) углеводороды (алканы)
- •Некоторые способы получения алканов
- •Алициклические соединения (нафтены)
- •Номенклатура, изомерия
- •Некоторые способы получения циклоалканов
- •Основные реакции алициклических углеводородов
- •Ненасыщенные (непредельные) углеводороды ряда этилена (алкены)
- •Номенклатура и изомерия
- •Некоторые способы получения этиленовых углеводородов
- •Непредельные ненасыщенные углеводороды ряда ацетилена (алкины)
- •Номенклатура и изомерия
- •Основные реакции ацетиленовых углеводородов
- •Ароматические углеводороды (арены)
- •Номенклатура и изомерия
- •Некоторые способы получения ароматических углеводородов
- •VI Высокомолекулярные органические соединения
- •Классификация полимеров
- •Методы получения
- •Ионная полимеризация
- •Процессы поликонденсации
- •Строение полимеров
- •Биополимеры
- •Каучуки
- •Вопросы для подготовки к экзамену
- •Список литературы
- •Приложения
- •Термодинамические характеристики некоторых веществ
- •Константы нестойкости комплексных ионов
- •Произведения растворимости труднорастворимых веществ (при комнатной температуре)
- •Растворимость солей, кислот и оснований в воде
Некоторые способы получения этиленовых углеводородов
Название реакции |
Примеры |
1. Крекинг алканов и пиролиз нефти
2. Дегидрогенизация алканов
3. Дегидратация спиртов
4. Дегидрогалогенирование |
С →СН2=СН – СН3 + СН4
С4Н10 СН2=СН – СН2 – СН3 (СН3 – СН=СН – СН3) + Н2 СН2=СН – СН=СН2 + Н2
СН3СН2ОН
СН3СН2Сl + KOH(спирт.р-р) → CH2=CH2 + KCl + H2O |
Для этиленовых углеводородов характерны реакции электрофильного присоединения (АЕ), которые протекают через две основные стадии:
Присоединение положительно заряженной частицы с промежуточным образованием катиона с положительным зарядом на атоме углерода (карбкатион):
+
>C=C< + A│:B → >C – C<
│
A
стабилизации карбкатиона за счёт присоединения аниона с образованием нейтральной молекулы:
+
>С – С < + В- → >C – C<
│ │ │
A B A
По такому механизму протекает реакция присоединения молекул галогена, воды и галогеноводородов.
В случае реакций несимметричных этиленовых углеводородов присоединение на первой стадии положительно заряженной частицы протекает таким образом, что промежуточно образуется самый устойчивый карбкатион, т.е. карбкатион, в котором положительный заряд максимально равномерно распределен по всей частице, например:
СН3СН=СН2 + HCl → CH3CHClCH3
Реакция протекает по правилу Марковникова: при ионном присоединении к несимметричным алкенам водород присоединяется по месту двойной связи к наиболее, а галоген – к наименее гидрогенизированному атому углерода. Поскольку из двух
+ +
возможных карбкатионов СН3СНСН3 (1) и СН3СН2СН2 (2) вторичный карбкатион (1) более стабилен по сравнению с карбкатионом (2) в результате большего погашения положительного заряда на атоме углерода за счёт двух СН3-групп, то реакция идет именно в данном направлении.
В общем, стабильность карбкатионов соответствует ряду:
Третичные > вторичные > первичные
+ + +
R3 – C R2 – CH R – CH2
Таблица 6
Основные реакции алкенов
Название реакции |
Примеры |
1. Реакции присоединения: гидрирования галогенирования гидрогалогенирования гидратации 2. Полимеризации
3. Реакции окисления: горения действие водного раствора KMnO4 при нагревании действие водного раствора KMnO4 при комнатной температуре (реакция Вагнера) каталитическое окисление (реакция Прилежаева)
4. Реакции дегидрирования
5. Реакции Дильса – Альдера (диеновые синтезы)
|
СН2=СН2 + Н2 СН3 – СН3 СН3–СН=СН2+Br2 → CH3 – CHBr – CH2Br СН3–СН=СН2 + HCl → CH3 – CHCl – CH3 СН3–СН=СН2 +H–OH → CH– CHOH – CH3
nСН2=СН2
nCH2=CH – CH=CH2 [-CH2 –CH=CH – CH2-]n
СН2=СН2 + 3О2 → 2СО2 + 2Н2О СН2=СН2 +KMnO4→2CO2+4MnO2 + 4KOH
3СН2=СН2 + 2KMnO4 + 4H2O → 3CH2OH – CH2OH + 2MnO2 + 2KOH
2
О оксид этилена
С2Н4 С2Н2 + Н2
СН СН2 СН СН2
│ + ║
С
СН2 СН2 |

 →СН3 – СН3 + СН2=СН2
→СН3 – СН3 + СН2=СН2 4Н10
4Н10

 СН2=СН2
+ O2
СН2=СН2
+ O2
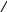

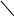 СН2
СН2
СН2
СН2
 Н
СН2 СН
СН2
Н
СН2 СН
СН2