
- •1. Основные гемодинамические параметры и их соотношения
- •2. Методы мониторинга кровообращения
- •2.1. Анализ поглощения легкими газообразного индикатора
- •2.2. Анализ разведения кровью жидкого индикатора
- •Показания к катетеризации ла
- •Возможные источники ошибок измерений с помощью катетера в ла1
- •Основные усовершенствования в технологии катетеризации ла
- •2.3. Методы визуализации объемов желудочков и эхолокации потоков
- •2.4. Методы, основанные на измерении электропроводности тканей
- •2.5. Сопоставление методов измерения мок
- •Корреляция результатов определения мок методами термодилюции и эхосонографии
- •Факторы, влияющие на совпадение результатов измерения мок методами термодилюции и импедансометрии
- •(По данным бд churchill livingstone library of anesthesia, 1996)
- •3. Кровообращение и аэробный энергетический обмен
- •4. Материал и методы наших исследований
- •4.1. Клинический материал исследования
- •4.2. Методы и средства анестезии
- •4.3. Методика искусственного кровообращения
- •4.4. Методы исследования
- •4.4.1. Общеклинические методы исследования
- •4.4.2. Специальные методы исследования
- •4.4.2.1. Технические средства и технологии
- •4.4.2.2. Методы расчета производных показателей
- •4.5. Архивация, обработка и представление результатов
- •5. Результаты наших исследований методов мониторинга гемодинамики
- •5.1. Импедансометрический мониторинг
- •5.1.1. Технологичность метода
- •5.1.2. Клиническая характеристика метода
- •Анестезиологическая карта
- •Анестезиологическая карта
- •5.2. Катетеризация легочной артерии и метод термодилюции
- •5.2.1. Клиническая характеристика метода
- •5.2.2. Методические приемы и рекомендации
- •5.3. Результаты сопоставления методов
- •5.4. Возможные подходы к повышению точности импедансометрического мониторинга
- •5.4.1. Совершенствование алгоритма обработки реосигнала
- •5.4.2. Калибровка реографического мониторинга
- •6. Заключение
- •1. Гемодинамические эффекты препаратов и методик анестезии
- •1.1. Ингаляционные анестетики
- •Гемодинамические эффекты ингаляционных анестетиков
- •1.2. Неингаляционные гипнотики
- •Гемодинамические эффекты неингаляционных гипнотиков и их антагонистов
- •1.3. Неингаляционные анестетики и аналгетики
- •Гемодинамические эффекты неингаляционных анестетиков, аналгетиков и их антагонистов
- •1.4. Некоторые комбинации препаратов
- •1.5. Миорелаксанты
- •Гемодинамические эффекты миорелаксантов
- •1.6. Регионарные и комбинированные методики анестезии
- •1.7. Гемодинамические критерии выбора препаратов и методик
- •2. Интерпретация и коррекция гемодинамики во время анестезии
- •2.1. Развитие подходов и основные проблемы
- •2.2. Гемодинамический профиль операции и анестезии
- •Гемодинамические эффекты стимулов, воздействующих на больного в связи с операцией и анестезией
- •2.3. Коррекция гемодинамики во время операции и анестезии
- •Гемодинамические эффекты препаратов, используемых для снижения ад во время анестезии
- •3. Результаты наших исследований гемодинамики во время анестезии
- •3.1. Вводные замечания
- •3.2. Гемодинамический профиль анестезии и операции
- •3.2.1. Начальный этап анестезии
- •3.2.1.1. Индукция общей анестезии
- •Критерии отбора больных в исследуемую группу
- •3.2.1.1.1. Индукция внутривенной анестезии
- •Гемодинамическии эффект
- •3.2.1.1.2. Индукция комбинированной анестезии с ивл
- •Гемодинамический эффект сочетания
- •Гемодинамический эффект сочетания диазепама, фентанила и ардуана
- •3.2.1.2. Центральные регионарные блоки
- •3.2.1.2.1. Спинальная анестезия
- •3.2.1.2.2. Эпидуральная анестезия
- •3.3. Гемодинамика на этапе поддержания анестезии
- •3.3.1. Поддержание анестезии фентанилом в сочетании с ингаляцией закиси азота и паров фторотана
- •3.3.2. Поддержание анестезии фентанилом и аденозинтрифосфатом натрия в сочетании с ингаляцией закиси азота и паров фторотана
- •3.3.3. Поддержание анестезии аденозинтрифосфатом натрия в сочетании с ингаляцией закиси азота и паров фторотана
- •3.3.4. Течение спинальной анестезии маркаином в сочетании с седацией диазепамом
- •3.4. Клинические особенности аденозиновой аналгезии
- •3.5. Коррекция гемодинамики во время операции и анестезии
- •3.6. Трактовка гемодинамических инцидентов
- •3.7. Оценка энергетической эффективности кровообращения
- •3.8. Опиоидная детоксикация под общей анестезией
- •4. Заключение
- •Оптимизация гемодинамического мониторинга
- •2. Клиническая оценка и коррекция режима гемодинамики
- •Интерпретация динамических сдвигов си и иопсс
- •3. Возможные направления дальнейших исследований
- •4. Заключение
5.2.2. Методические приемы и рекомендации
Малый (по сравнению, например, с многотысячными американскими статистиками [445, 1360 и др.]) объем нашего материала, безусловно, не позволяет делать глобальных выводов. Однако, учитывая специфику работы, возможно, наш опыт и соображения окажутся полезными для коллег, осваивающих катетеризацию ЛА для "штучного" использования у некардиохирургических больных.
Мы неоднократно наблюдали процесс установки катетера Swan-Ganz из рекомендуемого в литературе доступа через правую внутреннюю яремную вену [208, 666, 685], сами всегда пользуясь доступом через правую подключичную. С нашей точки зрения, последний доступ имеет следующие преимущества:
а) Учитывая большой калибр интродьюсера (не менее 6F) и, следовательно, размер дефекта стенки вены, более длинный подкожный тоннель, характерный для подключичного доступа, предпочтительнее с точки зрения профилактики онгиосептических осложнений. После извлечения катетера из ЛА удаление интродьюсера или его замена на стандартный ПХВ-катетер диаметром 1,4 мм чреваты меньшим риском наружного кровотечения или образования гематомы;
б) Подключичный доступ субъективно легче переносится больными в сознании, поскольку не требует накрывания лица стерильным бельем, а точка вкола расположена намного дальше от головы;
в) Интродьюсер и катетер в меньшей степени ограничивают движения больного и легче фиксируются повязкой; реже встречаются перегибы;
г) Доступ привычнее для большинства анестезиологов, особенно со стажем свыше 15-20 лет;
д) Он нисколько не затрудняет установки катетера;
е) Предложенная нами модификация доступа к подключичной вене (см. ниже) удлиняет подкожный тоннель до 5-8 см, дополнительно обеспечивая плотную фиксацию интродьюсера тканями передней грудной стенки и гарантирует при этом от повреждения купол плевры.
Несмотря на широкое использование подключичного венозного доступа, остается высокой частота связанных с ним осложнений — прежде всего пневмоторакса. В обучении пункции вены отсутствие очевидных гарантий создает психологический барьер при первых пункциях у больных.
Мы попытались построить для обучающихся алгоритм действий, точное следование которому с максимальной наглядностью гарантировало бы от повреждения плевры. Получилась следующая последовательность шагов.
1. Вкол иглы производится строго параллельно коже в кожную складку, собранную в произвольном направлении под средней третью ключицы, отступив от нее не менее 3 см.
2. Пальпируя иглу под кожей, продвигают ее к медиальной трети ключицы.
3. По достижении ключицы иглу погружают под ключицу, надавливая на нее сверху через кожу и одновременно продвигая вперед строго по оси. Изменение угла пункции в сагиттальной плоскости движениями руки со шприцем запрещается!
4. Далее продвижение иглы под контролем аспирации производится без изменений угла пункции. После пункции вены ее катетеризируют по любой из известных техник.
5. В случае непопадания в просвет вены игла выводится до точки пункции, а затем вновь продвигается по пп. 2, 3 и 4 под иным углом во фронтальной плоскости. Цикл повторяется до достижения результата.
Предложенная техника, взаимно отдаляя точки пункции кожи и вены, препятствует формированию опасного угла (игла продвигается по касательной к огибающей костного каркаса грудной стенки) и увеличивает длину подкожного туннеля, снижая риск септических осложнений. Создается большая терпимость к укладке больного, что важно у больных с ожирением, пожилых и во время операции, а реалистичные допуски в топографии легализуют неизбежную вариабельность точки пункции и направления движения иглы. Различие между традиционной и модифицированной техникой пункции иллюстрируют рис. 11 и 12. На рис.11 на фоне анатомических ориентиров (1 - яремная вена, 2 - ключица, 3 - подключичная вена, 4 - первое ребро) изображены традиционные точки вкола иглы при пункции правой подключичной вены (5 - точка R.Aubaniac (1952), 6 - точка J.J. Tofield (1 969), 7 - точка R. A. Mogi, D. A. Delaurentis и G. P. Rosemond (1967), 8 - точка D. Yoffa (1965), 9 _ точка 1. Happamemi и P. Slatis (1 974)) и зона1О, в которой возможен вкол иглы по предложенной нами методике. Рис.12 показывает технику пункции на этапах 2-4 описанного BbiaJe алгоритма.
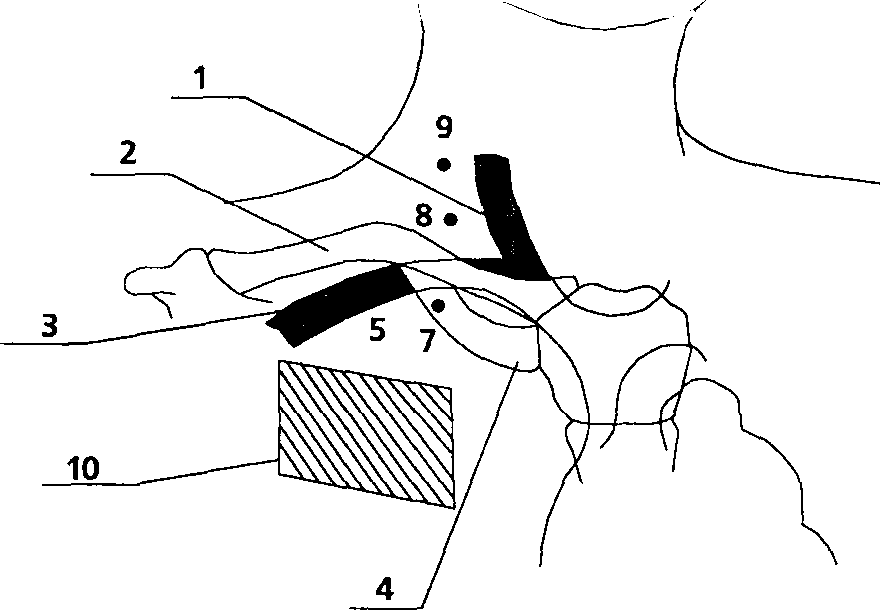
Рисунок 11.
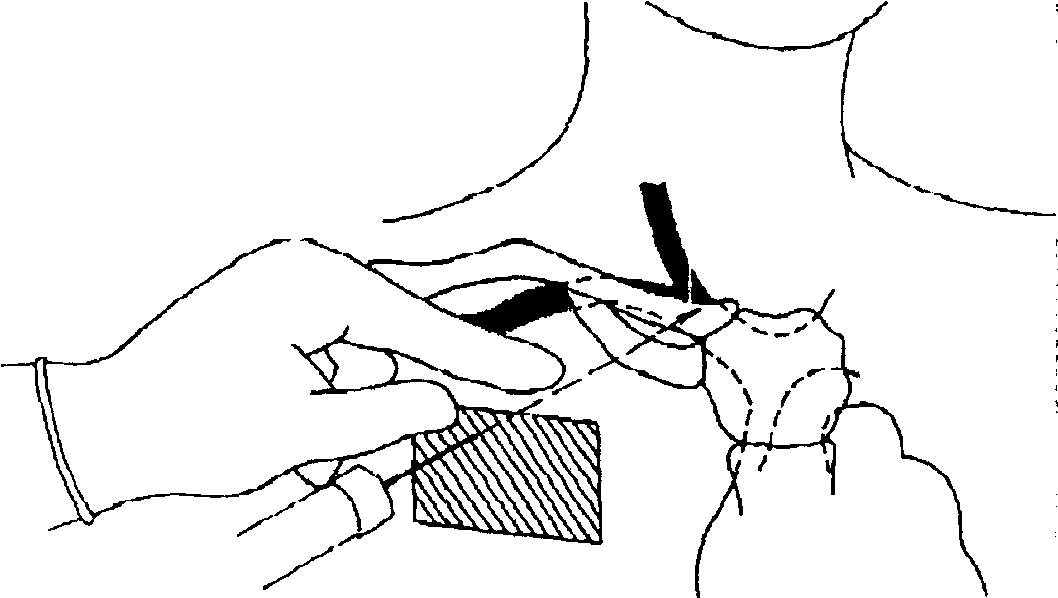
Рисунок 12.
Технические трудности при описанной методике иногда вызывает проведение катетера по проводнику (техника по S. Seldinger). Однако тщательное соблюдение п. 5 позволяет избежать взаимного натяжения слоев ткани, а использование импортных наборов для катетеризации, включающих дилататор, в том числе и комплекта интродьюсера катетера Swan-Ganz, вообще исключает проблему. Четырехлетний опыт использования предложенной модификации в учебном процессе и практической работе показал ее достаточно высокую эффективность: при условии соблюдения требований алгоритма случаев пневмоторакса мы не наблюдали. Во многих случаях вену удавалось пунктировать после неудачи классических способов. Использовав у взрослых больных катетеры различного калибра — вначале по причине отсутствия выбора — мы нашли катетер калибра 5F более удобным и безопасным. Аргументы в пользу применения у взрослых именно этого катетера следующие.
а) Меньший калибр необходимого интродьюсеро (6F вместо 7,5-8,5F) облегчает введение, уменьшает травму тканей и дефект стенки вены;
б) Катетер более гибкий и легче проводится в ЛА (возможно, это результат примененного нами подключичного доступа, при котором затруднено использование заводского изгиба катетера для облегчения его установки в рабочее положение);
в) Меньше вероятность травмы ЛА и клапанов правого сердца;
г) За счет меньшего диаметра раздутого баллончика меньше калибр заклиниваемой ветви ЛА: при диаметре баллончика, меньшем в 1,5 роза (8 мм против 12), соотношение площадей сечения окклюзируемых ветвей ЛА составит 1,52=2,25. Поскольку, по закону J.L.M. Poiseuille (1 840), сопротивление обратно пропорционально 4 степени радиуса сосуда, соотношение сопротивлений заклиниваемых участков составляет 1,54 5,1, что должно существенно ослаблять влияние обтурации на оксигенацию и ОЛСС, не затрудняя передачу на дистальный порт статического по своей природе давления из левого предсердия. Учитывая, однако, что топическое распределение легочного кровотока еще менее предсказуемо, чем путь катетера в ЛА, мы не пытались доказывать эти соображения опытным путем;
д) Наконец, проксимальный порт у катетера калибра 5F расположен на расстоянии 15 см от кончика, что обычно при рабочем положении катетера соответствует полости правого желудочка. Это дает возможность мониторировать кривую давления в ПЖ, постоянно верифицируя, таким образом, позицию катетера по двум точкам на его протяжении и своевременно парируя смещения [1319]. Проксимальный порт катетеров большего диаметра находится на большем удалении от кончика и рассчитан на мониторирование ЦВД, которое технически осуществимо и через интродьюсер. Неоднократно наблюдая процедуру катетеризации ЛА в исполнении более тренированных коллег, а затем осваивая методику, мы пытались уяснить факторы, влияющие на ее успех. Создалось впечатление, что определенную роль играет скорость введения катетера. Попытки его введения порциями по 10 см в руках ранее практиковавшегося врача неоднократно были безуспешными. В то же время, когда один из впервые выполнявших процедуру врачей вводил катетер порциями примерно по 1-2 см, установить его в положение заклинивания также не удалось. Катетер в последнем случае был успешно установлен при введении порциями по 4-6 см; по нашим наблюдениям, эта скорость является оптимальной, позволяя добиться успеха в подавляющем большинстве ситуаций. Возможно, нужно дать время катетеру прогреться по всей длине введенного отрезка до температуры тела, а потому не следует вводить его слишком быстро. Правда, вводя катетер через подключичную вену, мы не использовали для облегчения введения его заводской изгиб, рассчитанный на югулярный доступ. Однако неудач не было, а указанные преимущества подключичного доступа, с нашей точки зрения, перевешивают недостатки.
Наша практика полностью подтвердила правило: не вводить катетер дальше, если на протяжении 10 см не произошло изменения формы кривой давления, мониторируемой с его дистального порта [1494].
Визуальная оценка термодилюционных кривых и результатов измерения МОК показала, что на них существенно влияют фаза дыхания, степень равномерности и скорость введения индикаторного раствора. Учитывая два последних фактора, необходимость введения всей дозы индикатора в течение не более чем 4 с и отсутствие в нашем распоряжении дозатора с соответствующим темпом подачи, мы стали использовать следующий прием (рис.13). Независимо от силы исследователя, сопротивления канала и качества шприца, он всегда обеспечивает усилие, достаточное для быстрого равномерного введения индикатора.
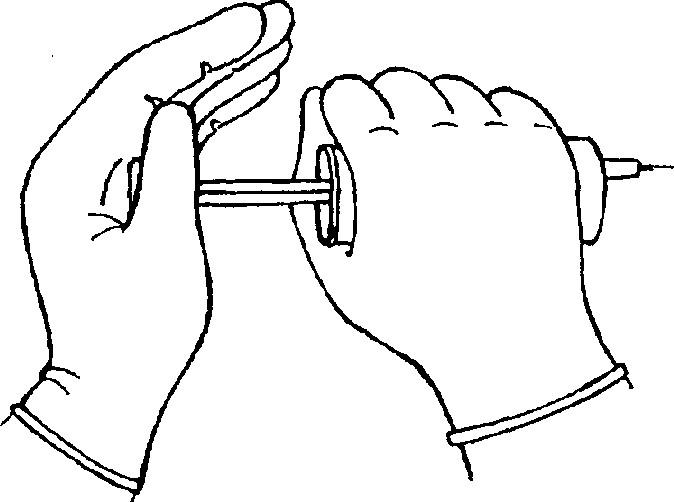
Рисунок 13.
