
- •Курсовая работа «Термодинамические расчеты»
- •Введение
- •Исходные данные для курсовой работы
- •2. Расчет изобарно-изотермического потенциала
- •2.1. Расчет δGтº по уравнению Гиббса (первый метод)
- •2.2. Расчет g0t по уравнению Гиббса-Гельмгольца (второй метод)
- •3. Расчет δgтº химической реакции образования соединения CuFeO2
- •3.1. Расчет δg400º
- •3.1.1. Расчет δg400º реакции по уравнению Гиббса (первый метод)
- •Вычисляем изменение коэффициентов зависимости теплоемкости от температуры: a, b, c´.
- •3.1.2. Расчет g0400 по уравнению Гиббса-Гельмгольца (второй метод)
- •3.2. Расчет δg500º
- •3.2.1. Расчет δg500º реакции по уравнению Гиббса (первый метод)
- •3.2.2. Расчет g0500 по уравнению Гиббса-Гельмгольца (второй метод)
- •3.3. Расчет δg600º
- •3.3.1 Расчет δg600º реакции по уравнению Гиббса (первый метод)
- •3.3.2. Расчет g0600 по уравнению Гиббса-Гельмгольца (второй метод)
- •3.4. Расчет δg700º
- •3.4.1. Расчет δg700º реакции по уравнению Гиббса (первый метод)
- •3.4.2. Расчет g0700 по уравнению Гиббса-Гельмгольца (второй метод)
- •3.5. Заключние
- •4. Расчет δGтº химической реакции образования соединения CuFe2o4
- •4.1. Расчет δg400º
- •4.1.1. Расчет δg400º реакции по уравнению Гиббса (первый метод)
- •4.1.2. Расчет g0400 по уравнению Гиббса-Гельмгольца (второй метод)
- •4.2. Расчет δg500º
- •4.2.1. Расчет δg500º реакции по уравнению Гиббса (первый метод)
- •4.2.2. Расчет g0500 по уравнению Гиббса-Гельмгольца (второй метод)
- •4.3. Расчет δg600º
- •4.3.1. Расчет δg600º реакции по уравнению Гиббса (первый метод)
- •4.3.2. Расчет g0600 по уравнению Гиббса-Гельмгольца (второй метод)
- •4.4. Расчет δg700º
- •4.4.1. Расчет δg700º реакции по уравнению Гиббса (первый метод)
- •4.4.2 Расчет g0700 по уравнению Гиббса-Гельмгольца (второй метод)
- •4.5. Заключение
- •Список литературы
4.5. Заключение
Результаты расчетов изменения изобарно-изотермического потенциала G0т, полученные по уравнению Гиббса и уравнению Гиббса-Гельмгольца для реакции образования CuFe2O4, приведены в таблице 3. Графическая зависимость G0т=f(T) показана на рисунке 2.
Таблица 3 – Значения величины G0т реакции образования CuFe2O4
Т, К |
298 |
400 |
500 |
600 |
700 |
G0т, кДж•моль-1 |
-262,5 |
-261,9 |
-263,9 |
-267,9 |
-273,9 |
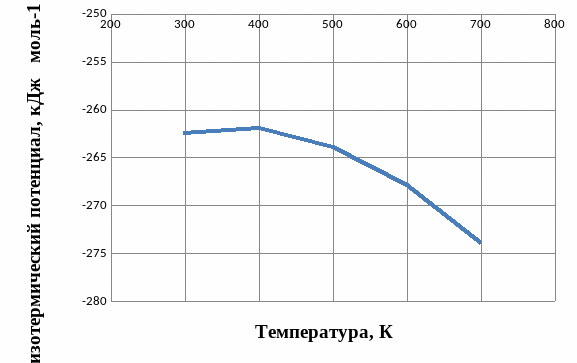
Рисунок 2 ˗ Зависимость изобарно-изотермического потенциала от температуры
Как показывают полученные результаты, реакция образования CuFe2O4 протекает в интервале температур от 298 до 700 К при стандартном давлении, с увеличением температуры её вероятность убывает в интервале температур от 298 до 400 К и возрастает в интервале температур от 400 до 700 К.
ВЫВОД
Термодинамический анализ системы «CuO ˗˗ FeO» и системы «CuO ˗˗ 2FeO» в интервале температур 298…700 К показывает, что энергетически наиболее вероятно протекание реакции образования CuFe2O4 (G0т= ˗262,5…˗273,9 кДж•моль-1). Реакция образования CuFeO2 будет протекать во вторую очередь (G0т= ˗164,9…˗161,2 кДж•моль-1).
Список литературы
1. Хомич В.А. Термодинамические расчеты: метод. указания к курсовой работе по физической химии для студентов специальности 330200 « Инженерная защита окружающей среды». – Омск: Изд-во СибАДИ, 2005. – 14 с.
2. Бобкова Н.М., Силич Л.М., Терещенко И.М. Сборник задач по физической химии силикатов и тугоплавких соединений: учеб. пособие для вузов. – Минск: «Университетское», 1990. – 175 с.
3. Кругляков П.М. Физическая и коллоидная химия: учебное пособие / П.М. Кругляков, Т.Н. Хаскова. 2-ое изд., испр. ˗ М.: Высшая школа, 2007. ˗ 319 с.
4. Краткий справочник физико-химических величин: учебное пособие / Ред. А.А. Равдель, А.М. Пономарева. ˗ 11˗е изд., испр. и доп. ˗ М.: As˗book, 2009. ˗ 240 с.
