
- •Курсовая работа «Термодинамические расчеты»
- •Введение
- •Исходные данные для курсовой работы
- •2. Расчет изобарно-изотермического потенциала
- •2.1. Расчет δGтº по уравнению Гиббса (первый метод)
- •2.2. Расчет g0t по уравнению Гиббса-Гельмгольца (второй метод)
- •3. Расчет δgтº химической реакции образования соединения CuFeO2
- •3.1. Расчет δg400º
- •3.1.1. Расчет δg400º реакции по уравнению Гиббса (первый метод)
- •Вычисляем изменение коэффициентов зависимости теплоемкости от температуры: a, b, c´.
- •3.1.2. Расчет g0400 по уравнению Гиббса-Гельмгольца (второй метод)
- •3.2. Расчет δg500º
- •3.2.1. Расчет δg500º реакции по уравнению Гиббса (первый метод)
- •3.2.2. Расчет g0500 по уравнению Гиббса-Гельмгольца (второй метод)
- •3.3. Расчет δg600º
- •3.3.1 Расчет δg600º реакции по уравнению Гиббса (первый метод)
- •3.3.2. Расчет g0600 по уравнению Гиббса-Гельмгольца (второй метод)
- •3.4. Расчет δg700º
- •3.4.1. Расчет δg700º реакции по уравнению Гиббса (первый метод)
- •3.4.2. Расчет g0700 по уравнению Гиббса-Гельмгольца (второй метод)
- •3.5. Заключние
- •4. Расчет δGтº химической реакции образования соединения CuFe2o4
- •4.1. Расчет δg400º
- •4.1.1. Расчет δg400º реакции по уравнению Гиббса (первый метод)
- •4.1.2. Расчет g0400 по уравнению Гиббса-Гельмгольца (второй метод)
- •4.2. Расчет δg500º
- •4.2.1. Расчет δg500º реакции по уравнению Гиббса (первый метод)
- •4.2.2. Расчет g0500 по уравнению Гиббса-Гельмгольца (второй метод)
- •4.3. Расчет δg600º
- •4.3.1. Расчет δg600º реакции по уравнению Гиббса (первый метод)
- •4.3.2. Расчет g0600 по уравнению Гиббса-Гельмгольца (второй метод)
- •4.4. Расчет δg700º
- •4.4.1. Расчет δg700º реакции по уравнению Гиббса (первый метод)
- •4.4.2 Расчет g0700 по уравнению Гиббса-Гельмгольца (второй метод)
- •4.5. Заключение
- •Список литературы
Введение
В курсовой работе следует рассчитать основные термодинамические функции:
энтальпии, энтропии, изобарно-изотермические потенциалы химических реакций образования 2-х соединений: CuFeO2; CuFe2O4 в интервале температур от 298 до 700 К. Термодинамические расчеты позволяют оценить возможность (вероятность) протекания химических реакций в заданных условиях, определить их направление и предпочтительность (очередность) протекания одной реакции перед другой.
Цель курсовой работы: освоение термодинамического метода исследования системы «CuO ˗˗ FeO» и системы «CuO ˗˗ 2FeO», а также протекающих в них химических реакций образования соединений CuFeO2 и CuFe2O4.
Исходные данные для курсовой работы
1) Формулы соединений: CuFeO2 и CuFe2O4.
2) Интервал температур: 298…700 К.
3) Термодинамические величины компонентов систем «CuO ˗˗ FeO» и системы «CuO ˗˗ 2FeO» приведены в таблице 1.
Таблица 1 ˗˗ Термодинамические величины соединений
Формула простых веществ и соединений |
Теплота образования из элементов, -H0 298, кДжмоль-1 |
Энтропия S0 298, Джмоль-1К-1 |
Теплоемкость Cp, Джмоль-1К-1 |
||
Коэффициенты уравнения Cp = а + вТ – СТ -2 |
|||||
а |
b103 |
c´10-5 |
|||
1 |
2 |
3 |
4 |
5 |
6 |
CuO |
157,03 |
42,63 |
43,83 |
16,76 |
5,88 |
FeO |
266,65 |
59,44 |
51,82 |
-6,78 |
-1,59 |
CuFeO2 |
592,6 |
88,7 |
95,6 |
10,63 |
16,65 |
CuFe2O4 |
959,0 |
141,0 |
138,62 |
119,41 |
22,76 |
4) Реакции образования соединений в смесях с соотношением исходных элементов компонентов 1:1 следующие:
CuO + FeO = CuFeO2,
CuO + 2FeO = CuFe2O4.
5) Определяем 5 значений температур для проведения термодинамических расчетов: 298, 400, 500, 600, 700 К.
2. Расчет изобарно-изотермического потенциала
2.1. Расчет δGтº по уравнению Гиббса (первый метод)
Исходные данные: ΔНº298, ΔSº298, Cp = а + вТ + СТ –2 веществ, участвующих в химической реакции.
1)Определяем энтальпию реакции при стандартной температуре 298 К.
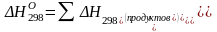 (1)
(1)
2) Находим изменение коэффициентов: Δа, Δв, Δс΄,определяющих зависимость Ср = ƒ(Т).
Δа = Σа(продуктов) - Σа(исходных веществ)
Δв = Σв (продуктов) - Σв(исходных веществ)
Δс´= Σс(продуктов) - Σс(исходных веществ) (2)
Находим энтропию химической реакции при 298 К.
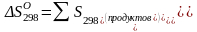 (3)
(3)
Определяем теоретическое значение изменения изобарно-изотермического потенциала реакции при температуре Т по уравнению Гиббса:
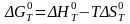 (4)
(4)
Для этого находим энтальпию реакции по уравнению
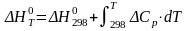 (5)
(5)
и энтропию реакции по уравнению
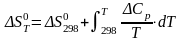 (6)
(6)
 Подставляя
выражения (6) и (5) в (4), получим уравнение,
по которому будем вычислять
изобарно-изотермический потенциал
реакции при температуре Т:
Подставляя
выражения (6) и (5) в (4), получим уравнение,
по которому будем вычислять
изобарно-изотермический потенциал
реакции при температуре Т:
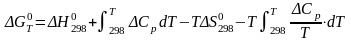 .
(7)
.
(7)
Рассчитываем
значение величины интеграла 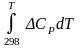 .
.
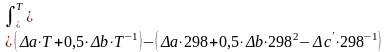 (8)
(8)
Рассчитываем значения величины интеграла
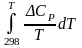 .
.
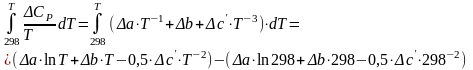 (9)
(9)
