
- •Теоретичні основи теплотехніки
- •1 Модуль
- •2 Модуль
- •Передмова
- •Модуль 1
- •1. Закони ідеальних газів
- •Завдання 1
- •Приклад розв’язання завдання 1 (об’ємне задання суміші)
- •Рішення
- •Приклад розв’язання завдання 1 (масове задання суміші)
- •Рішення
- •2. Цикли теплових двигунів
- •(Цикл Отто)
- •(Цикл Дизеля)
- •Завдання 2
- •Приклад розв’язання завдання 2
- •Рішення
- •Приклад розв’язання завдання 2
- •Рішення
- •3. Теплообмін при обтіканні пучка труб
- •Завдання 3
- •Приклад розв’язання завдання 3
- •Рішення
- •4. Теплопередача через плоску стінку
- •Завдання 4
- •Приклад розв’язання завдання 4
- •Рішення
- •Модуль 2
- •5. Термічний опір багатошарової стінки
- •Завдання 5
- •Приклад розв’язання завдання 5
- •Рішення
- •6. Розрахунок теплообмінних апаратів
- •Завдання 6
- •Приклад розв’язання завдання 6
- •Рішення
- •7 Труб.
- •7. Розрахунок теплообмінних апаратів при охолоджуванні.
- •Завдання 7
- •Приклад розв’язання завдання 7.
- •Рішення
- •8. Параметри вологого повітря
- •Завдання 8
- •Методика розв’язання завдання 8
- •Рішення
- •Додатки
- •Література
- •Видавець і виготовлювач Видавництво державного закладу «Луганський національний університет імені Тараса Шевченка»
Приклад розв’язання завдання 1 (об’ємне задання суміші)
Дано: Суміш газів має наступний об'ємний процентний склад: N2 – 40%, H2 – 30%, СО2 – 30%. Тиск суміші рсум = 0,095 МПа, її температура t = 450°C, об'єм Vсум = 2 м3. Визначити усі величини з пунктів 1-8 завдання.
Рішення
По таблиці Менделєєва знаходимо молярні маси компонентів суміші: для азоту μN2 = 28 кг/кмоль, для водню μН2 = 2 кг/кмоль, для вуглецевого газу μСО2 = 44 кг/кмоль.
1. Визначаємо середню молекулярну масу суміші при об’ємному задані:
![]()
2. Визначаємо масовий склад суміші:

3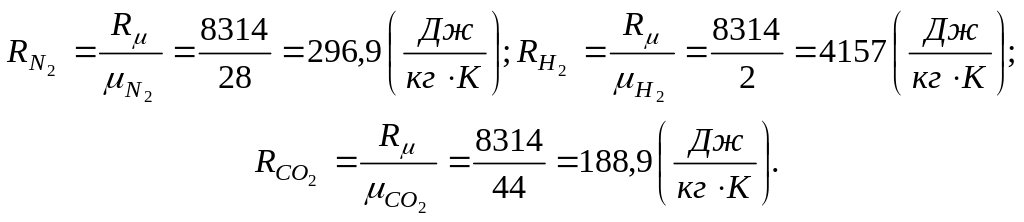 .
Визначаємо газові сталі компонентів і
суміші. Для компонентів суміші маємо
.
Визначаємо газові сталі компонентів і
суміші. Для компонентів суміші маємо
Для всієї суміші маємо
![]()
4. Визначаємо парціальний тиск компонентів суміші:

5. Визначення масу суміші і всіх її компонентів. Для цього переведемо температуру суміші в Кельвіни
![]()
Визначаємо масу суміші:
![]()
Маса окремих компонентів суміші:
 ,
,
6. Визначаємо густину та питомі об'єми компонентів і всієї суміші за заданих умов. Для густини всієї суміші маємо
![]()
Визначаємо густину окремих компонентів суміші

Питомий об’єм всієї суміші
![]()
Визначаємо питомий об’єм окремих компонентів суміші

7. Визначаємо густину і питомі об'єми компонентів і всієї суміші за нормальних фізичних умов. Для густини суміші маємо
![]()
Густина компонентів суміші за нормальних фізичних умов
 ,
,
Питомий об’єм всієї суміші за нормальних умов
![]()
Питомий об’єм окремих компонентів суміші за нормальних умов

![]()
8. Визначаємо питомі теплоємності компонентів і всієї суміші, які не залежать від температури. Значення молярних теплоємкостей μСр і μСυ беремо з табл. 2 Додатку, враховуючи, що N2 і Н2 – двохатомні гази, а СО2 – трьохатомний. Тоді питома молярна теплоємність суміші за постійного тиску і постійного об’єму
![]()
![]()
Питома об’ємна теплоємність суміші за постійного тиску і постійного об’єму
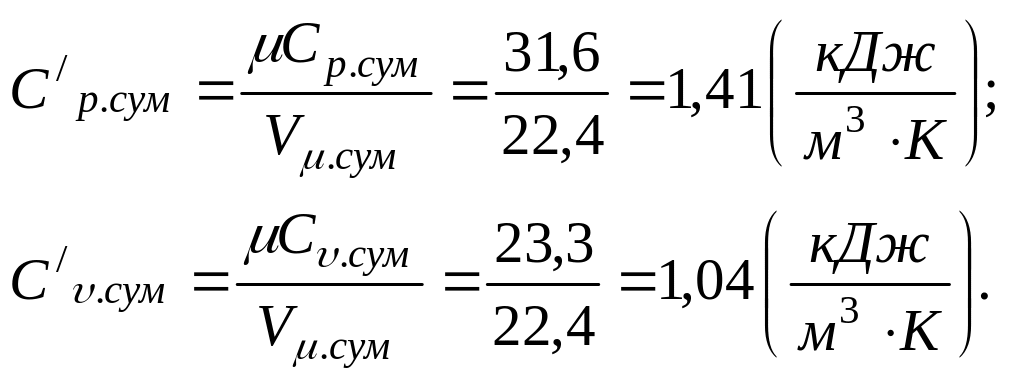
Питома масова теплоємність суміші за постійного тиску і постійного об’єму:

Приклад розв’язання завдання 1 (масове задання суміші)
Дано: Суміш газів має наступний масовий процентний склад: Н2 – 15%, H2О – 62%, СО2 – 23%. Тиск суміші рсум = 0,125 МПа, її температура t = 250°C, об'єм Vсум = 6 м3. Визначити усі величини з пунктів 1-8 завдання.
Рішення
По таблиці Менделєєва знаходимо молярні маси компонентів суміші: для азоту μН2 = 2 кг/кмоль, для водню μН20 = 18 кг/кмоль, для вуглецевого газу μСО2 = 44 кг/кмоль.
1. Визначаємо середню молекулярну масу суміші при масовому задані:

2. Визначаємо масовий склад суміші:
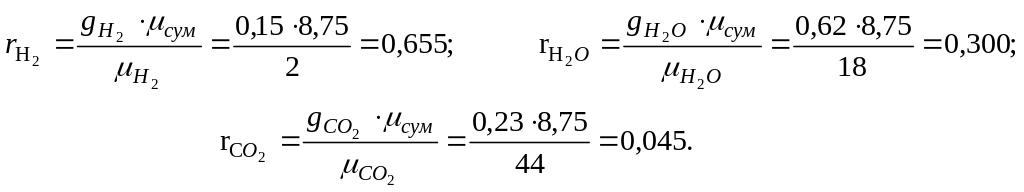
3 .
Визначаємо газові сталі компонентів і
суміші. Для компонентів суміші маємо
.
Визначаємо газові сталі компонентів і
суміші. Для компонентів суміші маємо
Для всієї суміші маємо
![]()
4. Визначаємо парціальний тиск компонентів суміші:

Виконання пунктів 5-8 є аналогічним як для масового, так і для об’ємного задання складу суміші, воно наведено в попередньому прикладі.
2. Цикли теплових двигунів
Теоретичні відомості
Двигун внутрішнього згоряння (ДВЗ) – теплова машина, що використовує в якості робочих тіл продукти згоряння рідких чи газоподібних палив, які спалюються всередині циліндру.
При вивченні роботи ДВЗ приймають наступні припущення:
1. Всмоктування та вихлоп, не вважаються термодинамічними процесами і не беруться до уваги, оскільки протікають за змінної кількості робочої речовини.
2. Хімічні властивості робочої речовини та її кількість на всіх стадіях не змінюються.
3. Процеси горіння розглядаються як підведення еквівалентної кількості теплоти до робочого тіла.
4. Видалення продуктів горіння еквівалентне відведенню теплоти від робочого тіла.
5. Усі процеси є рівноважними та зворотними, тобто втрати на тертя і теплопровідність до уваги не беруться.
Цикл з підведенням теплоти за постійного об’єму V = const
