
- •Общие вопросы анализа
- •Способы выражения концентраций растворов
- •Химическая посуда, правила работы
- •Мерная посуда
- •Подготовка мерной посуды к работе
- •Аналитические весы, правила взвешивания
- •Раздел 2. Титраметрические методы исследования.
- •Тема 2.1. Титраметрический метод. Основы метода:
- •Титриметрические методы исследования
- •Вопросы для самостоятельной работы
- •Тема 2.3. Методы окисления - восстановления. Перманганатометрия. Йодометрия Основы методов:
- •Основы метода
- •Лабораторная работа № 2. Установка титра рабочего раствора перманганата калия
- •Оборудование, посуда и реактивы
- •Порядок выполнения работы:
- •Тема 2.3. Методы окисления - восстановления. Перманганатометрия. Йодометрия Лабораторная работа № 3. Установка титра рабочего раствора тиосульфата натрия методом замещения
- •Посуда и реактивы
- •Порядок выполнения работы:
- •Тема 2.5. Методы комплексонометрии. Трилонометрия.
- •Лабораторная работа № 4. Комплексонометрия. Определение общей жесткости питьевой, природной и минеральной воды
- •Порядок выполнения работы
- •Вопросы для самостоятельной работы
- •Раздел 3. Оптические методы исследования
- •Тема 3.1. Колориметрический метод. Основы метода
- •Лабораторная работа № 5.
- •Приборы, посуда и реактивы
- •Порядок выполнения работы
- •Тема 3.6. Рефрактометрический метод. Основы метода:
- •Лабораторная работа № 6. Определение содержания сахарозы в водном растворе.
- •Лабораторная работа № 7. Определение сухих веществ в кондитерских изделиях
- •Тема 3.7. Поляриметрический метод.
- •Лабораторная работа № 8. Поляриметрический метод. Определение сахарозы в водном растворе
- •Лабораторная работа № 9. Определение лактозы в молоке
- •Список рекомендуемой литературы
Посуда и реактивы
Бюретка вместимостью 25 или 50 см3.
Пипетка Мора вместимостью 10 см3.
Мерная колба вместимостью 100 см3.
Коническая колба для титрования вместимостью 100 см3. Мерные цилиндры вместимостью 10 см3- 2 шт.
Химический стакан вместимостью 100 см .
Воронка диаметром 3 см.
Часовое или покровное стекло.
Экран для титрования.
Промывалка с дистиллированной водой,
Стандартный раствор дихромата калия, с(1/6К2Сг207) = = 0,2000 моль/дм3.
Рабочий раствор тиосульфата натрия, c(l/lNa2S203) и и 0,02 моль/дм3.
Раствор серной кислоты, c(l/2H2S04) = 2,0 моль/дм3.
Раствор иодида калия с массовой долей 10,0 %.
Раствор крахмала с массовой долей 0,5 %.
Порядок выполнения работы:
Приготовление стандартного раствора. Стандартный раствор дихромата калия готовят в мерной колбе разбавлением в 10 раз исходного раствора с молярной концентрацией эквивалента 0,2000 моль/дм3. Полученный раствор имеет молярную концентрацию эквивалента с(1/6К2Сг207) = 0,02000 моль/дм3.
Стандартизация рабочего раствора N028203- Бюретку через воронку заполняют рабочим раствором тиосульфата натрия. На штатив помещают экран для титрования.
В колбу для титрования мерными цилиндрами отмеряют 5- 7 см3 раствора KI и 5-10 см3 раствора серной кислоты. К полученной смеси мерной пипеткой прибавляют 10,00 см3 приготовленного раствора дихромата калия. Колбу закрывают часовым или покровным стеклом, чтобы предотвратить испарение 12. Для завершения реакции колбу помещают на 5 мин в затемненное место (рис. 13). Затем стекло снимают и ополаскивают из промы- валки водой, промывные воды собирают в колбу для титрования. Сразу приступают к титрованию.
Окрашенный в бурый цвет раствор титруют раствором тиосульфата натрия до светло-желтой окраски, когда в колбе останется небольшое количество свободного иода. Затем добавляют несколько капель раствора крахмала, раствор в колбе приобретает синий цвет, продолжают титровать до обесцвечивания раствора, Последние капли титранта прибавляют медленно, перемешивая раствор после каждой прибавленной капли.
Чтобы убедиться в правильности результата, в колбу добавляют 1 каплю стандартного раствора дихромата калия, при этом раствор приобретает бледно-синюю окраску.
Точное титрование выполняют не менее трех раз; результаты записывают в таблицу.
По результатам всех титрований рассчитывают молярную концентрацию эквивалента и титр раствора тиосульфата натрия:
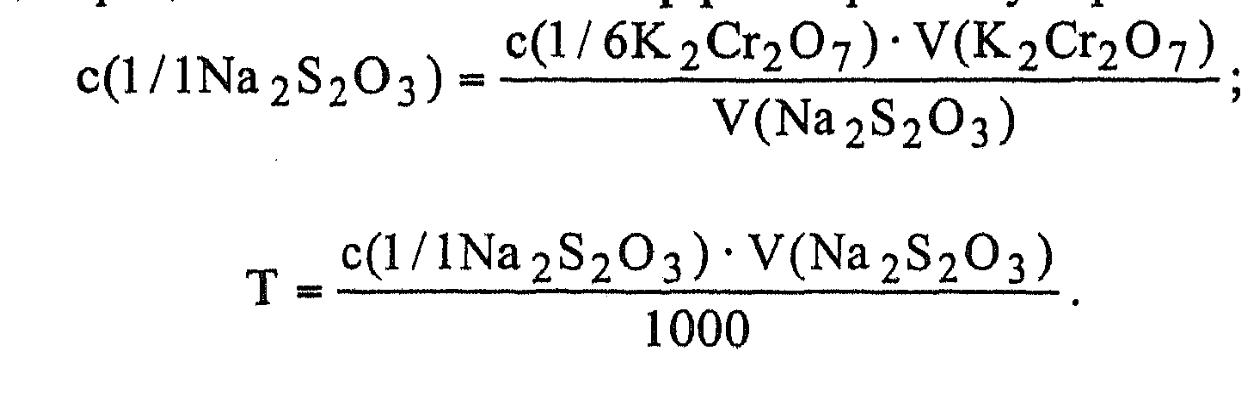
Тема 2.5. Методы комплексонометрии. Трилонометрия.
ОСНОВЫ МЕТОДА
Комплексометрия - титриметрический метод анализа, основанный на взаимодействии металлов с моно- или полидентатны- ми лигандами с образованием комплексных соединений. Для решения аналитических задач в комплексометрии в качестве тит- рантов применяют, как правило, полидентатные органические реагенты, так как только при этом можно получить четкий скачок на кривой титрования и зафиксировать точку эквивалентности.
Метод титрования с применением полидентатных органических реагентов (комплексонов) называется комплексонометрией. Начало применению комплексонов как аналитических реагентов положил швейцарский химик Г.Шварценбах (1945 г.). Комплексны относятся к классу полиаминополикарбоновых кислот. Эти соединения называются "хелатоны" (США), "трилоны" (Германия), "комплексоны" (Россия).
Наибольшее распространение и применение в анализе среди комплексонов получили комплексон II (ЭДТУ) - этилендиамин- тетрауксусная кислота
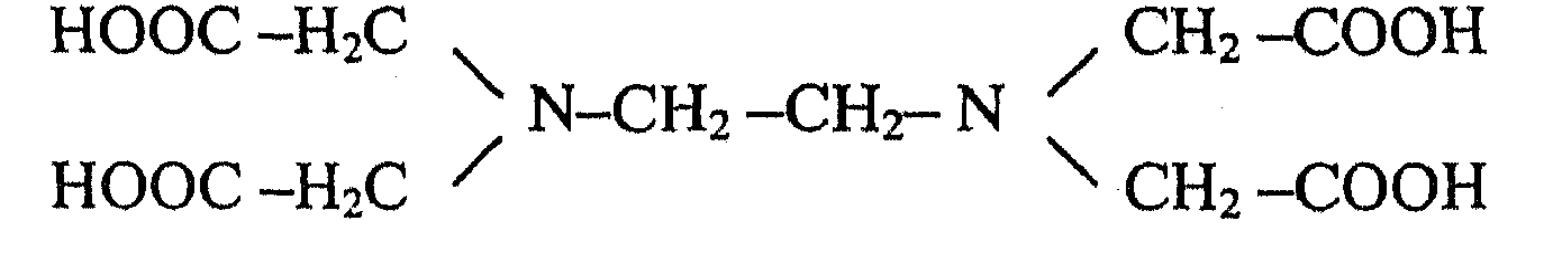
и хорошо растворимая в воде двунатриевая соль этилендиамин- тетрауксусной кислоты - комплексон III (ЭДТА)
Особенности строения комплексонов'.
Наличие в молекулах комплексонов нескольких групп кислотного характера (-СООН), атомы водорода которых способны замещаться на металл. При этом образуется валентная связь.
Присутствие двух атомов азота, имеющих неподеленную пару электронов и, следовательно, способных образовывать координационные связи с металлом.
Шесть функциональных групп с донорными атомами азота и кислорода позволяют комплексонам реагировать со всеми металлами, кроме металлов со степенью окисления 1, образуя комплексные соединения - комтексонаты,
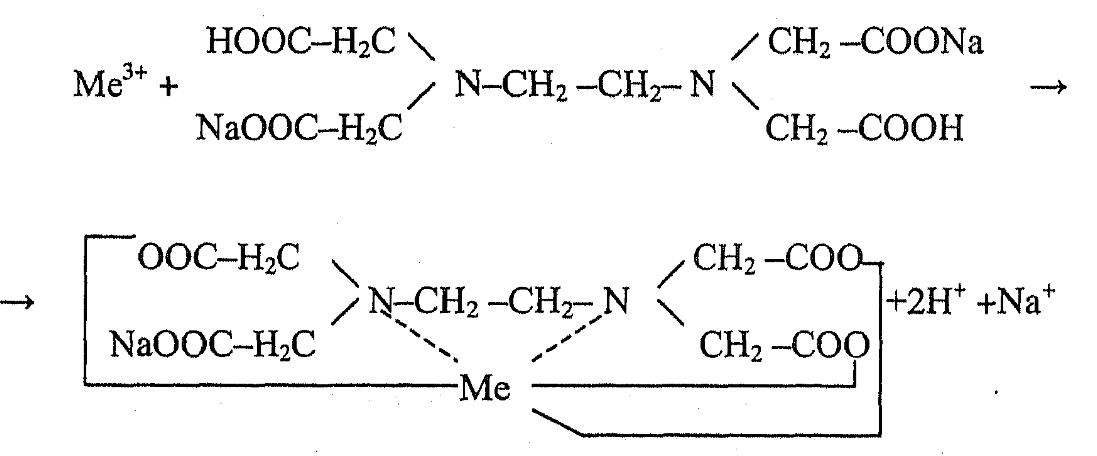
Реакция комплексообразования протекает мгновенно, практически необратима.
Свойства комплексонатов:
Комплексонаты - прочные соединения, слабые электролиты. Их прочность обусловлена наличием в молекуле двух видов связи (валентной и координационной) и замкнутых циклов, разветвленных в пространстве. Состояние комплексонатов в растворе характеризуется константой устойчивости ((3).
Чем выше степень окисления металла, тем устойчивее комплексонат и, следовательно, выше константа устойчивости
Независимо от степени окисления металла, комплексона- ты характеризуются одинаковым составом 1:1. Ступенчатое ком- плексообразование отсутствует. Поэтому эквиваленты металлов, как и комплексонов, равны 1.
Комплексонаты хорошо растворимы в воде, растворы их бесцветны.
Условия комплексе неметрического титрования. Реакция комплексообразования сопровождается изменением pH вследст- вие накопления протонов:
Ме2+ + H2Y 2~ ^iMeY2'+2Н+.
Изменение pH влияет на устойчивость комплексонатов: с увеличением pH устойчивость комплексонатов повышается. Поэтому Ме2+ определяют в щелочной или нейтральной среде, Ме3+ и Ме4+ - в кислой среде. При выборе условий титрования раствора соли определенного металла необходимо учитывать константу Р, которая прямо зависит от pH
Растворы, содержащие Mg , Са , Ва +, титруют при pH = 9 - 10 в присутствии аммонийной буферной смеси.
Особенность комплексонометрического титрования состоит в том, что в одной пробе без предварительного разделения можно раздельно определять катионы различных металлов, варьируя условия с помощью буферных растворов. Несколько металлов в растворе можно определять при условии, если константы устойчивости их комплексонатов отличаются более, чем на четыре порядка (pi/ р2>Ю4). При этом для титрования раствора соли каждого катиона должен быть свой индикатор.
Фиксирование точки эквивалентности. Для визуального фиксирования точки эквивалентности в комплексонометрии применяются металлоиндикаторы - органические соединения, изменение окраски которых зависит от концентрации ионов металла в растворе. Металлоиндикаторы с ионами титруемого металла образуют окрашенные комплексы.
Способы комплексонометрического титрования.
Прямое титрование. Применяется для определения содержания солей металлов в пищевых продуктах, питьевой, природной и сточной воде промышленных предприятий, в почвах (табл. 11). Надежный способ определения жесткости воды. Тит- рант - раствор комплексона III.
Обратное титрование. Применяется для определения солей металлов, когда трудно подобрать индикатор или при медленном взаимодействии ионов металла с титрантом. К анализируемому раствору добавляют избыток титрованного раствора комплексона III, не вступивший в реакцию остаток ЭДТА титруют раствором MgS04.
Косвенное титрование. Применяется для определения анионов (S042~; Р043~; С2042~ и другие). Анионы из раствора осаждают титрованным раствором соли металла, избыток которого затем оттитровывают раствором комплексона Ш.
Раствор комплексона III готовят по точной навеске в мерной посуде, но концентрацию раствора необходимо уточнять (препарат Na2H2Y 2Н20 гигроскопичен, массовая доля влаги до 0,3 % влаги). Стандартные вещества метода - MgS04, СаСОз, ZnCl2.
