
- •1.Идеальный газ.
- •16. Связь термодинамических параметров в политропных процессах.
- •27. Термодинамическое определение энтропии.
- •28.Теорема Нернста.
- •29. Статистический смысл энтропии.
- •3 0.График распределения молекул идеального газа за компонентой скорости для двух температур..
- •31. График распределения молекул идеального газа по модулю скорости для двух температур.
- •38.Температура вырождения.
- •39.Термостат.
1.Идеальный газ.
Идеальный газ — математическая модель газа, в которой предполагается, что: 1) потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией; 2) суммарный объём молекул газа пренебрежимо мал; 3) между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги; 4) время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
2.Темература газа.
Температура
- мера средней кинетической энергии
молекул
![]() (формулу
писать обязательно)
(формулу
писать обязательно)
3.Физические смыслы давления.
1.
В данной точке давление определяется
как отношение нормальной составляющей
силы ![]() ,
действующей на малый элемент поверхности,
к его площади:
,
действующей на малый элемент поверхности,
к его площади:
![]()
2.Давление равно импульсу передаваемому стенке молекулой в ходе одного перехода(акта)
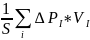 ,где
νi
– количество столкновений i
–ой частицы со стенкой S заединицу
времени, или
частота столкновений.
4.
Уравнение состояние идеального газа.
,где
νi
– количество столкновений i
–ой частицы со стенкой S заединицу
времени, или
частота столкновений.
4.
Уравнение состояние идеального газа.
![]()
5. Основное уравнение молекулярно-кинетической теории идеального газа.
Основное
уравнение МКТ связывает макроскопические
параметры (давление, объём, температура)
термодинамической системы с
микроскопическими (масса молекул,
средняя скорость их движения).
![]() ,
так как
,
так как
![]() ,
то
,
то
![]()
6.
Теорема о равномерном распределении
энергии по степеням свободы.
![]()
![]()
7.Закон парциальных Давлений Дальтона.
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
![]()
8.Закон Авогадро.
В равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул
9.Молярная
теплоемкость
Это
физическая величина, численно равная
количеству теплоты, которое необходимо
передать одному молю (данного) вещества
для того, чтобы его температураизменилась
на единицу.
![]() где c —
молярная теплоёмкость, Q — количество
теплоты,
полученное веществом при нагреве (или
выделившееся при охлаждении), ν —
количество вещества в нагреваемом
(охлаждающемся) образце, ΔT —
разность конечной и начальной температур.
10.Связь
между молярной и удельной теплоемкостями.
где c —
молярная теплоёмкость, Q — количество
теплоты,
полученное веществом при нагреве (или
выделившееся при охлаждении), ν —
количество вещества в нагреваемом
(охлаждающемся) образце, ΔT —
разность конечной и начальной температур.
10.Связь
между молярной и удельной теплоемкостями.
c - удельная (на единицу массы, на 1 кг) Дж/кг*К C - молярная (на 1 моль, для числа молекул или атомов равномого числу Авогадро) Дж/моль*К (Выведите массу через моль, или наоборот) 11. Термодинамическое равновесие.
Термодинамическое
равновесие —
состояние системы,
при котором остаются неизменными по
времени макроскопические величины этой
системы.
Условия:
1. Химическое
равновесие,т.е в равновесной гетерогенной
системе химические потенциалы любого
компонента должны быть одинаковыми для
всех фаз, в которых этот компонент
находится.
2.Тепловое равновесие.
Одинаковая температура во всех частях
системы.
3.Механическое равновесие.
Давление во всех частях системы
одинаковое.
12.Первый
закон термодинамики.
Количество
теплоты,
полученное системой, идёт на изменение
её внутренней энергии и совершение
работы против внешних сил
![]() =
=
![]() +
+
![]()
13. Функции процесса, функции состояния. , - имеют неполный дифференциал.Функции процесса зависят не только от текущего состояния системы, но также и от пути, по которому система пришла в данное состояние. - функция состояния. Функции состояния зависят только от текущего состояния системы и не зависят от пути, по которому система пришла в это состояние.
14.Функция состояния. Функции состояния зависят только от текущего состояния системы и не зависят от пути, по которому система пришла в это состояние.
15. Политропные процессы. Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
