
- •Раздел 1. Методологические основы безопасности жизнедеятельности
- •Сущность понятия «безопасность». Иерархические уровни и сферы безопасности. Предмет безопасности жизнедеятельности. Основные объекты и компоненты бжд.
- •2.Охарактеризуйте систему «человек-техносфера» как основной объект бжд. Каковы особенности эволюции современной среды обитания?
- •3.Сформулируйте условия благоприятного (с точки зрения бжд) взаимодействия человека и техносферы. Перечислите состояния системы «человек-среда обитания» в зависимости от этого взаимодействия
- •4. Человек как объект и субъект безопасности. Роль человеческ. Фактора в обеспечении безопасности.
- •5. Охарактеризуйте естествен сис защиты чел-а от опасностей. З-н Вебера – Фехнера.
- •7.Сформулируйте основные аксиомы бжд.
- •8.В чем состоит идентификация квантификация опасностей?
- •9.Дайте понятие риска. Изложите суть концепции приемлемого риска.
- •10.Дайте понятие безопасности. Каковы основные критерии безопасности? Приведите примеры объектов защиты и соответствующих им систем безопасности.
- •11. Сущность системного анализа без-ти. Графо-аналитические методы выявления причинно-следственных связей, априорный и апостериорный анализ.
- •12. Логико-методологическая схема анализа и проектирования объектов техносферы по условиям бжд. Стратегия мер без-ти при проектировании машин и технологий.
- •13.Основные принципы, методы и средства обеспечения без-и. Классификация, хар-ка, примеры.
- •14. Методические основы управления риском и бжд. Иерархические уровни, целевые и функциональные подсистемы управления.
- •Раздел II. Экологическая безопасность и охрана окружающей среды
- •Экология и природопользование
- •1. Экология и природопользование: объект и предмет исследования. Цели, задачи и направления развития данных наук.
- •2. Экосистемы и системы природопользования: сущность, содержание, структура и закономерности развития.
- •Региональное природопользование: методы, механизмы регулирования и инструменты управления. Территориальные системы природопользования. Экспертиза природопользования на примере Кург обл.
- •4. Типы и виды пп . Критерии рационального природопользования. Характеристика одного из видов пп, его функциональная структура.
- •5. Прир ресурсы, их классификация и проблемы национального использования. Виды оценок природных ресурсов.
- •Ресурсные циклы. Территориальные природно - ресурсные системы. Динамика природно-ресурсного потенциала, методы измерения и оценок.
- •8. Сущность,содержание, цели и задачи инженерной экологии. Природно – технические ( эколого - экономические) системы: уровни и организация, трансформация и проблемы сбалансированного развития.
- •9. Природные и антропогенные ландшафты: сущность, структура, отличия и динамика развития.
- •10. Типология и классификация ландшафтов. Потенциалы ландшафтов (в т.Ч. Экологической). Экодиагностика территории и состояния ландшафтов. Ландшафты Кург области.
- •11. Техносфера и биосфера, техносферный и биосферный круговороты в-в: сравнительный анализ.
- •Основные законы экологии и пп: характеристика и особенности
- •13. Эколого-хоз баланс территории и эколог каркас: сущность, структура (на примере любой территории)
- •16 Обосновать основные направления экологизации производства, снижение его природоемкости и отходности на примере предприятия (цеха)
- •18. Используя статистические данные, экологические карты Курганской области и России дать сравнительный анализ антропогенной нагрузки на территории двух регионов.
- •18.2 Сравнительный анализ Курганской и Челябинской областей
- •18.3 Сравнительный анализ Курганской и Челябинской областей
- •19. Используя статистический материал, определить уровень социально-экологического развития территории, степень их устойчивости
- •19.2 Используя статистический материал, определить уровень социально-экологического развития территории, степень их устойчивости
- •1. Место (рейтинг) районов на карте области
- •2. Показатели экономической эффективности
- •3. Социально-демографические показатели
- •4. Экологические показатели
- •2.2 Техногенные воздействия. Экологическая безопасность
- •Что вы понимаете под «загрязнением» природной среды? Приведите классификацию техногенных загрязнений с точки зрения их материально – энергетической природы.
- •4. Привести номенклатуру показателей и методов их определения для установления пригодности воды к хозяйственно питьевому водопользованию.
- •5.Методы и средства и условия измерения параметров газопылевого потока в газоходе котельной?
- •6. Критерии для установления степени опасности твердых отходов? Классиф-ция отходов производства и потребления.
- •7. Фотоактивные вещества и фотохимические реакции в атмосфере.
- •8. Реакции образования аэрозолей. Процессы конденсации и их разновидности.
- •9. Условия образования смогов и туманов
- •11. Влияние газообразных загрязнителей на материалы
- •12. Влияние газообразных загрязнителей на изменение прозрачности атмосферы и понижение температуры поверхности Земли.
- •13. Структура распределения загрязнителей в гидросфере
- •14. Структура основных водных масс и особенности кинетики химических реакций в водных системах.
- •15. Газообмен с гидросферой. Особенности поглощения химических веществ гидросферой.
- •16. Влияние органических веществ на гидросферу. Эвтрофикация водоемов.
- •17. Структура почвы. Органические вещества в почве.
- •18. Живое население почвы. Экологическое значение химических веществ для почвы.
- •19. Дайте понятие экологической безопасности. Какими основными критериями характеризуется экологическая безопасность территориальных природно-хозяйственных комплексов?
- •21. Что вы понимаете под экологическим риском?Источники и факторы эколог риска. В чем заключается экологический подход при оценке техногенного риска?
- •28. Определить количество металлической стружки
- •31. В водоёме, являющемся источником хозяйственно-питьевого водопользования, обнаружены загрязняющие вещества в следующих концентрациях:
- •33. Рассчитать индекс суммарного загрязнения атмосферы (иза) в крупном промышленном центре по данным
- •35. Оператор промышленной рентгеновской установки получил за 1996-2000 гг. Дозу облучения 90 мЗв, в том числе за 1999 г.– 40 мЗв. Соответствует ли такая доза требованиям радиационной безопасности?
- •2.3 Мониторинг среды обитания
- •2.Наземные методы и средства контроля среды обитания:
- •3. Аэрокосмический мониторинг. Дистанционные методы и средства контроля загрязнения среды обитания.
- •4. Критерии оценки состояния среды обитания. Мониторинг и нормирование выбросов и сбросо зв.
- •5. Организация систем контроля воздуха
- •6. Мониторинг загрязнения водных объектов.
- •7 Мониторинг фонового загрязнения. Био- и литомониторинг.
- •8. Место региональной системы мониторинга среды обитания в государственной системе мониторинга.
- •9. Проанализировать известные вам параметры и критерии комплексной оценки состояния среды обитания и предложить на ваш взгляд наиболее эффективные.
- •2.4 Экологизация производства и защита окружающей среды
- •Основные тенденции и направления экологизации производства
- •2. Общая хар-ка методов и средств защиты ос
- •3. Теоритические основы и параметры процессов пылеулавливания.
- •4. Классификация методов и аппаратов пылеулавливания и улавливания газовых примесей.
- •5. Очистка газов в пылеосадит камерах и аппаратах сухой инерционной очистки.
- •6. Очистка газов фильтрованием. Механизмы и теория процесса фильтрования.
- •7. Очистка газов в пылеуловителях мокрого типа. Физические основы и теория мокрой очистки газов.
- •8 Электрическая очистка газов. Механизм и физические основы электрич очистки газов.
- •11.Классификация и основные хар-ки методов защиты гидросферы.
- •13. Механич очистка ст вод от нерастворимых загрязнителей.
- •Процеживание и отстаивание
- •16.Биологическая очистка сточных вод.
- •20. Класс-ия общих и спец методов перераб-ки и обезвреж-е тверд отходов.
- •22. Промышленные технологии переработки отходов основных производств.
- •24. Методы и системы защиты от акустического загрязнения.
- •25. Защита от вибрационного загрязнения.
- •26. Защита от радиационного загрязнения
- •27. Защита от электромагнитного загрязнения.
- •29. Для защиты окружающей среды от промышленных загрязнений могут применяться разнообразные методы, в частности:
- •30.Определите эффективность очистки пылеуловителя (циклона), если массовые концентрации примесей в газовом потоке равны:
- •3. Промышленная безопасность и от. Защита в чс.
- •3.1 Бт. Требования без-ти к опо.
- •1. Основные направления обеспечения бт на предприятии.
- •2. Методы и средства нормализации воздушной среды и параметров микроклимата в производственных помещениях.
- •Изоляция является основным способом электробезопасности в сетях до 1000 в, т.К. Применение изолированных проводов обеспечивает достаточную защиту от напряжения при прикосновении к ним.
- •9.Общие требования безопасности к производственным процессам и оборудованию.
- •10. Критерии и правовые основания отнесения производ-х объектов к категории опасных. Идентификация и регистрация опасных объектов.
- •11. Общие требования промышленной безопасности к опасным производ объектам, технич-ие устройствам, зданиям и сооружениям.
- •12. Обеспечение безопасности труда при применении грузоподъемных механизмов.
- •13. Обеспечение безопасности труда при эксплуатации сосудов работающих под давлением.
- •14. Классификация условий труда. Гигиенические критерии оценки условий труда по показателям вредности и опасности производ среды, тяжести, напряженности труд процесса.
- •16. Методика оценки травмобезопасности рабочих мест
- •20 Опасные и вредные производственные факторы. Классификация, медико-биологические особенности воздействия на организм человека. Гигиеническое нормирование.
- •23. Электромонтер прикоснулся одновременно к двум оголенным фазным зажимам электродвигателя, питающегося от трехфазной сети с глухозаземленной нейтралью напряжением 380/220 в.
- •26. В помещении механообрабатывающего цеха выделяется в течение часа 804 мг/ч чугунной пыли. Определить потребный воздухообмен общеобменной вентиляции.
- •29. На механообрабатывающем участке имеется система общего освещения с газоразрядными лампами. При этом на стол отк площадью 2 м2 падает световой поток 500 лм.
- •34.В производственном помещении выделяется в воздушную среду несколько вредных веществ однонаправленного действия (см. Таблицу).
- •36. Оценить тяжесть и напряженность трудового процесса слесаря – ремонтника при выполнении описанной ниже работы.
- •3.2. Эргономические основы бжд
- •Вопрос 1. Цели и задачи эргономики. Понятие счм.
- •Вопрос 2. Цели и объекты исследования инженерной психологии
- •Вопрос 3. Эргономические требования к организации рабочего места.Совместимость характеристик «среда» и «ч».
- •4. Перечислить методы профилактики утомления, монотонии труда и стрессовых ситуаций.
- •Вопрос 5. Учет требований эргономики при проектировании человеко-машинных систем.
- •6. Методика эргономического анализа деятельности оператора технической системы.
- •3.3. Анализ техногенного риска
- •1. Состояние и причины аварийной опасности в техногенной сфере.
- •2. Как классифицируются промышленные аварии и катастрофы по масштабу распространения, типам и видам чс.
- •3. Дайте характеристику количественных и качественных показателей риска
- •4. В чем сущность концепции не нулевого риска, критерии приемлемого риска.
- •5. В чем сущность системного анализа источников техногенного риска
- •6. Какова процедура оценки риска техногенных аварий
- •7. Характеристика методов анализа риска, используемых для выявления и идентификации опасных событий
- •Практические задания
- •3.4. Предупреждение техногенных аварий и защита в чс
- •1. Классификация чс. Причины возникновения, стадии и типовые сценарии развития чс.
- •2 Прогнозирование и оценка последствий чрезвычайных ситуаций
- •3. Назначение и основные задачи Единой государственной системы предупреждения и ликвидации чрезвычайных ситуаций (рс чс).
- •4. Организационная структура, задачи, режимы деятельности рс чс.
- •5. Цель и задачи го, полномочия организаций в области го.
- •6. Нормативно-правовые основы государственного регулирования в области защиты населения и территорий от чс.
- •7. Экономическое регулирование деятельности в области предупреждения и ликвидации чс.
- •8. Государственная экспертиза и государственный надзор в области защиты населения и территорий от чс.
- •10. Цели и задачи аСиДнр. Особенности проведения аСиДнр при ликвидации последствий стихийных бедствий.
- •12. Техногенные чс, основные характеристики. Действия населения при возникновении техногенных чс.
- •13. Чс воен времени, основные хар-ки. Действие населения при возникновении чс воен времени (на примере одного из видов средств массового поражения).
- •14) Понятие о горении и взрыве. Физико-химические основы горения.
- •15) Теории горения.
- •16 Условия возникновения и развития процессов горения.
- •17) Взрывы. Типы, классификация, энергия, мощность, форма ударной волны, длительность импульса.
- •18. Чрезвычайные ситуации, вызванные взрывами
- •19. Чрезвычайные ситуации, вызванные пожарами
- •Определение категорий помещений и зданий по взрывопожарной и пожарной опасности.
- •22.Основные принципы и средства пожаротушения. Огнетушащие в-ва.
- •33.В производственном корпусе располагаются механосборочный и термический цехи площадью соответственно 800 м2 и 200 м2. Определить, к какой категории по пожарной опасности относятся:
- •Раздел IV. Правовые и организационные основы бжд. Менеджмент в техносфере
- •4.1 Правовые основы бжд
- •Правовое регулирование бжд. Система законодательства в области бжд.
- •Источники экологического права. Правовая охрана окружающей природной среды.
- •Правовые основы охраны труда и пром без-ти
- •Правовые основы гражданской обороны, защиты населения и территорий в чс.
- •Нормативные правовые акты в области бжд. Системы стандартов в области охраны природы и безопасности труда. Комплекс стандартов «Безопасность в чс».
- •Охарактеризуйте виды юридической ответственности за правонарушения в области бжд.
- •Правовые основы социального страхования рисков (несчастных случаев, опо экологич рисков).
- •4.2.Экспертиза безопасности
- •2. Роль, задачи и функции Федеральной службы по экологическому, технологическому и атомному надзору в проведении экспертизы безопасности.
- •4.Экологические требования при размещении, проектировании, строительстве, реконструкции, вводе в эксплуатацию предприятий, сооружений и иных объектов.
- •6.Цели, задачи, процедура (этапы) оценки воздействий на окружающую среду.
- •7.Заключение государственной экологической экспертизы. Основное содержание, приобретение юридической силы, правовые последствия.
- •8. Экспертиза мероприятий по охране воздушного бассейна. Порядок разработки нормативов пдв
- •9. Экспертиза водоохранных мероприятий. Порядок разработки нормативов пдс.
- •10. Порядок проведения технического расследования причин аварий, требования к содержанию и оформлению результатов расследования.
- •11. Организационная структура, задачи и функции. Системы экспертизы промышленной безопасности.
- •II. Основные определения
- •III. Общие положения
- •12. Порядок проведения экспертизы пб. Классиф и перечень объектов экспертизы.
- •13. Цели и задачи проведения экспертизы проектной документации. Отражение вопросов промышленной безопасности в проектной документации.
- •VI. Порядок ведения учета экспертных организаций и экспертов
- •14. Декларирование безопасности опасных производственных объектов
- •16. Декларирование, лицензирование и страхование опо.
- •17.Государственная экспертиза условий труда. Цели и задачи и порядок проведения. Определение классов профессионального риска.
- •Положение о проведении государственной экспертизы условий труда в Российской Федерации (утв. Постановлением Правительства рф от 25 апреля 2003 г. N 244) (с изменениями от 1 февраля 2005 г.)
- •19. Разработчиком проектной документации азс предусмотрен ряд природоохранных мероприятий по охране поверхностных и подземных вод от загрязнения:
- •20. Разработчик проектной документации в материалах раздела «Охрана окружающей среды», по мнению эксперта, недостаточно проработал один из подразделов. Каковы могут быть действия эксперта?
- •4.3.Экономика и менеджмент в тефносфере. Управление бжд
- •Понятие менеджмента в техносфере. Принципы и методы менеджмента организации. Социально – психологические основы менеджмента.
- •2. Методы и процедуры принятия управленческих решений.
- •3. Понятие менеджмента в бжд. Соотношение понятий «управление» и «менеджмент». Экологический менеджмент. Менеджмент охраны труда, управлению безопасностью и риском.
- •4.Системный подход в управленииБжд. Модель и струк-функц схема сис управления бжд (субж)
- •5. Органы и структура упр-ия бжд в рф.
- •6. Правовое обеспечение упр-ия бжд.
- •7. Основные методы управления бжд.
- •8. Методика, основные этапы и показатели эколого-экономического анализа хозяйственной и природоохранной деятельности
- •9. Экономический ущерб от загрязнения ос и методы его оценки.
- •10. Методические основы определения платы за негативное воздействие на ос. Понятие нормативного, лимитного и сверхлимитного загрязнения.
- •11.Экономическая оценка стоимости природных ресурсов и плата за их использование.
- •12.Составляющие экологического ущерба от неблагопр условий труда (ут), производственного травматизма и профессиональных заболеваний.
- •13.Экономические последствия чс
- •14. Оценка экономической эффективности мероприятий по охране труда и обеспечению промышленной безопасности.
- •15. Методология оценки экономической эффективности мероприятий по охране труда и обеспечению промышленной безопасности.
- •16. Методы экономического регулирования в области охраны окружающей среды и экологической безопасности:
- •17. Формирование экономического механизма управления охраной труда и промышленной безопасностью.
- •18. Субот на предприятии. Нормативно-метод основы. Структурно-функц модель.
- •19. Организационная структура и функции управления от. Служба от, ее задачи и функции, нормативы численности.
- •15. Методология оценки экономической эффективности мероприятий по от и обеспечению пром безопасностью.
- •20. Методы анализа и прогнозирования безопасности труда. Идентификация опасностей и оценка риска.
- •21. Расследование несчастных случаев. Статистические показатели и методы анализа производственного травматизма.
- •22. Основные положения сэу (эм). Понятие, норматив-методич основы, принципиальная модель, этапы создания, критерии эффективности.
- •23. Экологический аудит. Опыт развития, задачи ифункции. Аудит в системе управления ос.
- •24. Экологическая сертификация как инструмент управления экологической безопасностью. Форма подтверждения экологического соответствия. Сертификация систем экологического управления.
- •25. Цели, стратегии и инструменты экологического маркетинга в деятельности предприятия.
- •26. Страхование рисков как элемент экономического механизма управления бжд. Экологическое страхование, страхование промышленных рисков, страхование от несчастных случаев.
- •Практич задание
- •28.По данным промышленно-санитарной лаборатории уровни шума и вибрации на рабочих местах механообрабатывающего участка имеют следующие значения:
- •29.Вне территории предприятия могут иметь место несчастные случаи:
- •Системный анализ и моделировании. Информационное обеспечение управление бжд.
- •Понятие системы, характеристика и классификация систем. Примеры сис-м в техносфере, их основные признаки и св-ва.
- •2. Общие принципы системного анализа и синтеза. Исследование методологических средств системного анализа в экологии и бжд.
- •3. Общие принципы моделирования опасных процессов в техносфере. Классификация и структура моделей, применяемых для системного анализа безопасности.
- •6. Моделирование и синтез технологий и тех средств защиты ос (на примере моделирования и проекторование циклона)
- •7. Структурная модель системы «человек-машина-среда» (счмс). Использование модели для системного анализа и управления счмс.
- •8. Основные принципы программно-целевого планирования, обеспечение безопасности, анализа и синтеза систем управления безопасностью (производственной, экологической).
- •9.Методы экологического моделирования. Приведите примеры.
- •7.Моделирование процессов принудительной аэрации в потоках загрязненных рек
- •8.Экологическое моделирование жизни океана
- •10.Использование информационных технологий в управлении бжд. Приведите примеры
- •11.Информационное обеспечение системы управления безопасностью труда.
- •2. Пк «Призма» Программный комплекс «Кедр» для предприятий
- •Программный комплекс серии «Призма» для предприятий
- •Программный комплекс «Stalker»
- •Программный комплекс «шум»
- •Банки данных
- •12. Информационные сис поддержки принятия решений и экспертные сис в сфере экол, природопользования и бжд
- •13. Структура и организация локальных сетей, их администрирование. Возможности и перспективы использования персональных и групповых информационных технологий в сфере бжд.
12. Влияние газообразных загрязнителей на изменение прозрачности атмосферы и понижение температуры поверхности Земли.
Хозяйственная деятельность человека привела к изменению отдельных компонентов климата, которые в свою очередь оказывают влияние на человека и окружающую среду. Хозяйственная деятельность привела к возникновению парникового эффекта.
Рисунок
В результате выбросов в атмосферу в тропосфере образовался слой многоатомных газов способных поглощать солнечную энергию. Для нормального баланса солнечной энергии необходимо чтобы тепло получаемое поверхностью земли днем соответствовало теплу отдаваемому землей ночью. Тепло, задерживается многоатомными газами, не уходит обратно и температура увеличивается.
Другой сценарий основан на том, что в воздухе присутствует огромное количество пыли, эта пыль поглощает солнечные лучи, не пропуская их на земную поверхность. Это приводит к понижению температуры в нижних слоях и разница температур ∆t (температурный градиент) приводит к образованию вихрей, торнадо, ураганам.
13. Структура распределения загрязнителей в гидросфере
Загрязнения попадающие в водные объекты при любых условиях находятся в атмосфере в растворенном виде, либо в форме взвеси. Дальнейшая судьба загрязнений зависит от его реакционной способности, от доступности реакционных центров: физического, химического или биологического происхождения.
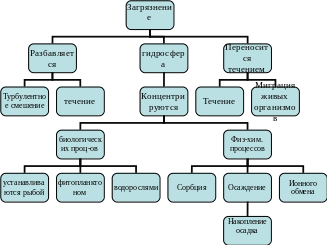
Загрязнения, поступающие в гидросферу, разносятся и переносятся в результате турбулентного смешения, течением потока и живыми организмами. Все загрязнения в гидросфере концентрируются биологическими объектами, т.е. усваиваются рыбой, фитопланктонами, водорослями и накапливаются в них. За счет физ-хим. процессов (сорбция, осаждение, ионный обмен) происходит накопление осадка или в зависимости от содержания ионов его растворение.
Все химические вещества, поступающие в гидросферу, несут угрозу водной системе, т.к. вода сама по себе содержат большой спектр веществ как в растворенном виде, так и в виде суспензии. Только в том случае когда содержание отдельного компонента велико, он начинает оказывать действия на экологическую систему мы можем считать его загрязнителем. Природа имеет огромные ресурсы и способность поглощать, регулировать содержание химических веществ однако когда содержание накопленного вещества превышает его расход, то данный компонент становится загрязнителем, такой уровень называется пороговым, ниже этого порога экосистема приспосабливается к поступающему веществу за счет естественных природных процессов. Выше этого уровня естественные процессы не в состоянии регулировать экосистему.
14. Структура основных водных масс и особенности кинетики химических реакций в водных системах.
1.Поверхностная пленка 50-500мкм толщиной. Все равновесные процессы масса обмена протекают в этой области. На глубине 200 мкм отмечается самое высокое содержание загрязнений.
Поверхностные водные массы. Сюда проникает солнечный свет, для слоя характерна биологическая активность, обусловленная протеканием фотосинтеза. Вода хорошо прогревается, поступают питательные вещества, отмечается наибольшее содержание флоры и фауны.
3. Глубинные водные массы. Отличаются высоким давлением и низкой температурой. Не проникает солнечный свет и вся жизнь в этом слое обеспечивается за счет энергии химической реакции.
4. Придонные водные массы. Это слой воды, в котором реакции переноса приобретают дополнительное значение, т.к. здесь происходит перенос химических веществ к осадку и обратно, т.е. растворение осадка и перенос химических веществ, в придонный слой.
5. Осадок. Сюда выпадают все нерастворенные и частично растворенные вещества, т.е. осадок аккумулирует все загрязнения. При изменении рН среды и окислительно-восстановительных характеристик ее осадки могут растворяться и в результате ионного обмена выпадать опять в осадки. Биологическая активность донных осадков, т.е. наличие микроорганизмов способствует преобразованию химических соединений, при этом образованные соединения могут сильно отличаться от первоначальных.
Если раствором является чистая вода, то реакция протекает по обычному типу
аА+bB↔cC+dD
Kp =[C]c * [D]d / [A]a * [B]b
Во всех остальных случаях более корректным является термодинамическое выражение в котором учитываются активности химических веществ.
Kap = acC * adD / aaA * abB
где Кaр – термодинамическая константа равновесия.
Связь между концентрацией и активностью выражается как а=γ*с, где γ- мольный коэффициент активности, с-концентрация.
Kap = Kp * (γc * γD / γA * γB)
При бесконечном равновесии Кра = Кр.
В сложных водных системах присутствуют комплексообразования, могут также присутствовать конкурирующие реакции.
Например: Ag+ + Cl-→AgCl↓
AgCl↓ + Cl-→AgCl2 (растворимое соединение)
AgCl2 + CN-→[AgCl2CN]-1 (растворимое соединение).
Такая реакция будет проходить с образованием растворимых солей до заполнения координационного числа металлов.
Таким образом, реакции протекающие в водных системах зависят от давления и температуры, а также от конкурирующих и совместно протекающих равновесных состояний. Другим фактором влияющим на ход химических реакций является наличие большой концентрации ионов, изменяющих ионную силу и определяющих свойства полученного раствора.
