
Министерство образования и науки Российской федерации
Уральский федеральный университет
имени первого Президента России Б. Н. Ельцина
УТВЕРЖДАЮ
Зам. директора ХТИ
__________ Безматерных М.А.
Фотометрическое исследование кинетики гомогенных реакций
Лабораторная работа по курсам «Физическая химия»,
«Дополнительные главы физической химии»
для студентов, обучающихся по программе бакалавриата
по направлениям подготовки 240700 − Биотехнология
240100 − Химическая технология
Рассмотрена на заседании кафедры физической и коллоидной химии
От ноября 2013 г протокол №
Зав. кафедрой Марков В.Ф.
Рассмотрена на заседании методической комиссии ХТИ ноября 2013 г
Протокол №
Председатель методкомиссии ХТИ Миролюбов В.Р.
Екатеринбург 2014
УДК 66.092-977(075.8)
ББК 35.5я73
Составитель Степановских Е.И.
ФОТОМЕТРИЧЕСКОЕ ИССЛЕДОВАНИЕ КИНЕТИКИ ГОМОГЕННЫХ РЕАКЦИЙ: лабораторная работа / Екатеринбург: УрФУ, 2014. −8 с.
Рассмотрена лабораторная работа по разделу курсов «Физическая химия» и «Дополнительные главы физической химии». Описание экспериментальной части лабораторной работы соответствует изданному ранее пособию [1], однако работа существенно переработана в связи с новыми рабочими планами специальностей и использованием нового оборудования. К ней добавлено расчетное аналитическое задание.
Библиогр.: 4 назв.
© Уральский
федеральный
университет, 2014
Цели работы
Фотометрическое исследование кинетики гомогенных реакций; решение прямой и обратной задач кинетики.
Задания на лабораторную работу
А. На основании экспериментальных данных определить константу скорости реакции красителя кристаллическогo фиолетового со щелочью.
Б. Решить прямую и обратную кинетические задачи для реакции разложения комплексного оксалата марганца.
Теоретические основы работы
Интенсивность окраски щелочных растворов красителя кристаллического фиолетового убывает во времени из-за образования бесцветного продукта реакции − карбинола. Известно, что эта реакция взаимодействия кристаллического фиолетового со щелочью относится к реакциям второго порядка и является необратимой. Кинетическое уравнение реакции имеет вид
![]() ,
(1)
,
(1)
где
![]()
скорость реакции (здесь и далее
рассматривается скорость реакций в
закрытых системах постоянного объема);
k
константа скорости;
скорость реакции (здесь и далее
рассматривается скорость реакций в
закрытых системах постоянного объема);
k
константа скорости;
![]() – концентрации красителя кристаллического
фиолетового и щелочи в системе в разные
моменты времени, так называемые «текущие»
концентрации.
– концентрации красителя кристаллического
фиолетового и щелочи в системе в разные
моменты времени, так называемые «текущие»
концентрации.
Обычно
концентрация щелочи гораздо больше,
чем концентрация кристаллического
фиолетового, т.е.
![]() >>
>>
![]() .
В этом случае при протекании реакции
концентрация щелочи в рабочем растворе
практически не меняется во времени,
оставаясь равной начальной ее концентрации
.
В этом случае при протекании реакции
концентрация щелочи в рабочем растворе
практически не меняется во времени,
оставаясь равной начальной ее концентрации
![]() .
Обозначив k
через
.
Обозначив k
через
![]() (
−
эффективная константа скорости), получим
из (1)
(
−
эффективная константа скорости), получим
из (1)
![]() .
(2)
.
(2)
Реакция второго порядка становится реакцией псевдопервого порядка. Дифференциальное кинетическое уравнение такой реакции выглядит следующим образом
![]() ,
(3)
,
(3)
где
(![]() )
=
)
=
![]() − «текущая» концентрация красителя, а
интегральная форма кинетического
уравнения имеет вид
− «текущая» концентрация красителя, а
интегральная форма кинетического
уравнения имеет вид
![]() .
(4)
.
(4)
Из анализа (4) следует, что если кинетика данной реакции действительно описывается уравнением первого порядка, то экспериментальные данные на графике зависимости логарифма текущей концентрации красителя от времени расположатся по прямой линии и по угловому коэффициенту этой линии можно найти эффективную константу скорости исследуемой реакции. А затем, если известна начальная концентрация щелочи, то и истинную константу скорости.
Снятие
кинетической кривой в данной работе
осуществляют с использованием
физико-химического метода − фотометрии.
Это возможно, потому что между оптической
плотностью раствора D
и концентрацией красителя в некотором
диапазоне концентраций
![]() от
0 до 1·102
моль/м3
существует линейная зависимость,
описываемая законом Бугера−Ламберта
– Бера
от
0 до 1·102
моль/м3
существует линейная зависимость,
описываемая законом Бугера−Ламберта
– Бера
![]() , (5)
, (5)
где
![]() – мольный показатель поглощения
излучения кристаллическим фиолетовым;
– мольный показатель поглощения
излучения кристаллическим фиолетовым;
![]() – толщина поглощающего слоя.
– толщина поглощающего слоя.
Оптическая плотность среды по определению равна
![]() ,
,
где
![]() и I
–
поверхностная
плотность потока излучения (интенсивность
излучения), падающего на внешнюю
поверхность среды и прошедшего через
среду.
и I
–
поверхностная
плотность потока излучения (интенсивность
излучения), падающего на внешнюю
поверхность среды и прошедшего через
среду.
Учитывая, что единственным веществом, дающим окраску раствора, является кристаллический фиолетовый, уравнение (5) можно записать
![]() ,
(6)
,
(6)
и преобразовать интегральное кинетическое уравнение (4) к виду
![]() или
или
![]()
![]() .
(7)
.
(7)
Если
на графике зависимости
![]() от времени (рис.1.) экспериментальные
данные будут располагаться по прямой
линии, то этой будет служить подтверждением
указанного порядка реакции с одной
с
от времени (рис.1.) экспериментальные
данные будут располагаться по прямой
линии, то этой будет служить подтверждением
указанного порядка реакции с одной
с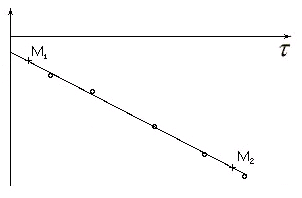 тороны,
и позволит определить эффективную
константу скорости, с другой стороны.
тороны,
и позволит определить эффективную
константу скорости, с другой стороны.
Рис. 1
У
![]() ,
(8)
,
(8)
где
![]() ;
;
![]() и
и
![]() ;
;
![]() – координаты двух произвольно выбранных
точек
– координаты двух произвольно выбранных
точек
![]() и
и
![]() на прямой, усредняющей экспериментальные
данные.
на прямой, усредняющей экспериментальные
данные.
Из
уравнения (7) видно, что
![]() . По
известной концентрации щелочи в растворе
можно найти истинную константу скорости:
. По
известной концентрации щелочи в растворе
можно найти истинную константу скорости:
![]() .
.
