

Исследование кинетики реакции омыления сложного эфира щелочью кондуктометрическим методом
Методические указания к лабораторной работе
по курсам «Физическая химия», «Дополнительные главы физической химии»
для студентов, обучающихся по программе бакалавриата
по направлениям подготовки 240700 − Биотехнология
240100 − Химическая технология

УДК 66.092-977(075.8)
ББК 35.5я73
Составитель Степановских Е.И.
ИССЛЕДОВАНИЕ КИНЕТИКИ РЕАКЦИИ ОМЫЛЕНИЯ СЛОЖНОГО ЭФИРА ЩЕЛОЧЬЮ КОНДУКТОМЕТРИЧЕСКИМ МЕТОДОМ: лабораторная работа / Екатеринбург: УрФУ, 2014. −12 с.
Рассмотрена лабораторная работа по разделу курсов «Физическая химия» и «Дополнительные главы физической химии». Описание экспериментальной части лабораторной работы соответствует изданному ранее пособию [1], однако работа существенно переработана в связи с новыми рабочими планами специальностей и использованием нового оборудования. К ней добавлено расчетное аналитическое задание.
В приложении приведены справочные материалы.
Библиогр.: 4 назв.
© Уральский
федеральный
университет, 2014
Библиографический список
1. Химическая кинетика: Учебное пособие - практикум для лабораторных работ/ Н.К. Булатов, А.Б. Лундин, Ю.Н. Макурин, Е.И. Степановских, Л.А. Брусницына, Т.А. Петухова Екатеринбург: УГТУ−УПИ, 2007. −81 с.
2. Физическая химия. Электрохимия. Химическая кинетика и катализ: учеб.пособие для вузов: в 2 кн./ под ред. К. С. Краснова. - 3-е изд., испр. - М.: Высшая школа, 2001.Кн. 2. - 319 с.
3. Стромберг А. Г. Физическая химия / А. Г. Стромберг, Д. П. Семченко; под ред. А. Г. Стромберга ; 2-е изд., перераб. и доп. М. : Высш. шк., 2001. 496 с.
4. Определение параметров кинетических уравнений: учебное пособие/ Е. И. Степановских, Ю. Н. Макурин, Л. Н. Маскаева, И. М. Морозова.− Екатеринбург: УГТУ−УПИ, 2008. −73 с.
Цели работы
Изучение кинетики реакции омыления сложного эфира щелочью, решение прямой и обратной задач кинетики.
Задания на лабораторную работу
А. Определить константу скорости реакции омыления этилацетата щелочью в водной среде по экспериментальным данным.
Б. По имеющимся данным решить прямую и обратную кинетическую задачу для реакции омыления метилацетата щелочью в водной среде.
Теоретические основы работы
Омыление
сложных эфиров щелочью описывается
стехиометрическим уравнением
![]() .
Продуктами ее являются спирт и соль
соответствующей карбоновой кислоты.
.
Продуктами ее являются спирт и соль
соответствующей карбоновой кислоты.
Кинетически − это необратимая реакция второго порядка.
![]() ,
(1)
,
(1)
где cэф и cщ – текущие концентрации эфира и щелочи соответственно;
k – константа скорости исследуемой реакции.
При сэф,о = сщ,о = co дифференциальная и интегральная формы кинетического уравнения будут следующими
![]() ,
,
![]() .
(2)
.
(2)
У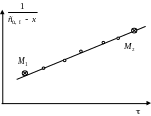 равнение
(2) представляет собой линейную зависимость
равнение
(2) представляет собой линейную зависимость
![]() от времени
от времени
![]() (рис. 1), угловой коэффициент которой
(рис. 1), угловой коэффициент которой
![]() .
.
Рис. 1
Определив по графику a, тем самым найдем k. Как следует из уравнения (2) для расчета константы скорости реакции необходимо на опыте определить зависимость концентрации щелочи от времени при заданной температуре. В данной работе эта задача решается с помощью кондуктометрического метода.
Получим необходимые соотношения для расчета концентраций реагентов по данным кондуктометрических измерений.
Запишем стехиометрическое уравнение исследуемой реакции в ионной форме:
![]() .
.
В
ходе реакции концентрация ионов
гидроксила убывает, а концентрация
ионов
![]() возрастает. Концентрация ионов Na+
остается неизменной. Подвижность ионов
возрастает. Концентрация ионов Na+
остается неизменной. Подвижность ионов
![]() значительно превосходит подвижность
ионов
,
поэтому электропроводность раствора
с течением времени падает. Удельную
электропроводность æ исследуемого
раствора в любой момент времени
значительно превосходит подвижность
ионов
,
поэтому электропроводность раствора
с течением времени падает. Удельную
электропроводность æ исследуемого
раствора в любой момент времени
![]() ,
отличный от 0 и
,
отличный от 0 и
![]() ,
можно представить как сумму трех
слагаемых, одно из которых (æ
,
можно представить как сумму трех
слагаемых, одно из которых (æ![]() )
обусловлено ионами Na+,
другое (æ
)
обусловлено ионами Na+,
другое (æ![]() )
– гидроксильными ионами
и третье (æ
)
– гидроксильными ионами
и третье (æ![]() )
– ионами
)
– ионами
![]() :
:
æ![]() =
æ
+
æ
+
æ
.
(3)
=
æ
+
æ
+
æ
.
(3)
Удельная
электропроводность æk
связана с эквивалентной концентрацией
![]() ионов вида k
в растворе соотношением
ионов вида k
в растворе соотношением
æ
k![]() ,
(4)
,
(4)
где
![]() – подвижность (эквивалентная
электропроводность) соответствующих
ионов.
– подвижность (эквивалентная
электропроводность) соответствующих
ионов.
В
рассматриваемой реакции все ионы
являются однозарядными (zк
=
1), поэтому эквивалентная концентрация
ионов каждого вида
![]() совпадает с их мольно-объемной
концентрацией
совпадает с их мольно-объемной
концентрацией
![]() .
Следовательно,
.
Следовательно,
æ
k
![]() .
.
В соответствии с этим уравнение (3) можно записать в виде
æ
τ
![]() .
(5)
.
(5)
Если
суммарная концентрация ионов невелика,
то можно принять, что подвижность ионов
любого вида
![]() равна их предельной подвижности
равна их предельной подвижности
![]() .
Согласно стехиометрическому уравнению
реакции
.
Согласно стехиометрическому уравнению
реакции
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
Подставляя эти значения концентраций ионов в уравнение (5), получим
æτ
![]() .
(6)
.
(6)
В начальный момент времени ( = 0) x = 0 и, следовательно,
æ
о
![]() .
(7)
.
(7)
Отсюда
![]() æо
/(
æо
/(
![]() ).
(8)
).
(8)
![]() (
æо
æτ)
/(
(
æо
æτ)
/(![]() ).
(9)
).
(9)
![]() æо
/(
)
(
æо
æτ)
/(
).
(10)
æо
/(
)
(
æо
æτ)
/(
).
(10)
