
- •1. Основные приборы и оборудование для практических работ по молекулярной биологии
- •Практическая работа № 2 анализ днк методом электрофореза в агарозном геле
- •Практическая работе № 3 выделение и фракционирование наулеиновых кислот эукариот классическими методами
- •Занятие № 1 экстракция днк из животных организмов с ддс-Na
- •2. Состав и приготовление экстрагирующего буфера ов
- •Занятие № 2 став-экстракция днк из растений
- •Занятие № 3 выделение тотальной рнк по шерреру
- •Занятие № 4 фракционирование и определение соотношений _. Рибосомальных и транспортных рнк методом электрофореза в полиакриламидном геле
- •18 А фракции рнк, %
- •Занятие № 5 определение константы седиментации рнк методом электрофореза в полиакриламидном геле
- •Практическая работа № 4 выделение нуклеиновых кислот с использованием сорбентов
- •Занятие № 1 выделение днк с использованием набора d1атом™ dna prep 100
- •Занятие № 2
- •Практическая работа № 5 выделение плазмидной днк из рекомбинантных бактериальных клеток
- •5. Раствор I для выделения плазмидной днк
- •Практическая работа № 6 определение концентрации и качества препаратов нуклеиновых кислот методом -спектрофотометрии
- •Практическая работа №7 постановка полимеразной цепной реакции
- •358 Промотор вируса мозаики цветной капусты
- •Практическая работа № 9 реакция обратной транскрипции
- •Практическая работа №10 рестрикционный анализ днк
- •7.Условия рестрикции
- •Практическая работа №11 днк—днк-гибридизация
- •8. Значения максимумов поглощения (абсорбции) и испускания света (эмиссии) некоторых флуорофоров
- •Практическая работа №12 клонирование фрагментов днк в клетках
- •Практическая работа № 13 определение первичной структуры днк
- •Практическая работа № 14 информационный поиск с использованием баз данных интернета
- •Практическая работа № 15 экстракция белков из животных и растительных тканей
- •Практическая работа № 16 осаждение белков сульфатом аммония
- •9. Последовательность фракционирования белков сульфатом аммония
- •Практическая работа № 17 диализ белков
- •Практическая работа № 18 количественное определение белка по методу лоури
- •Практическая работа № 19 количественное определение белка по методу брэдфорд
358 Промотор вируса мозаики цветной капусты
(регистрационный номер ген. банка Х04879)
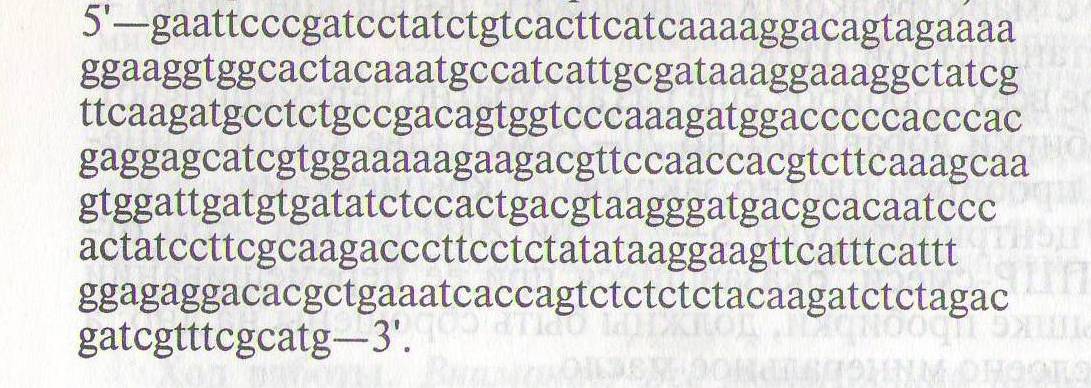
Практическая работа №8
ОЧИСТКА ДНК-ФРАГМЕНТОВ ПОСЛЕ
ИХ РАЗДЕЛЕНИЯ МЕТОДОМ ПРЕПАРАТИВНОГО
ЭЛЕКТРОФОРЕЗА В АГАРОЗНОМ ГЕЛЕ
Электрофорез как метод фракционирования заряженных молекул (ДНК, РНК, белков) в электрическом поле был представленнами ранее как аналитический метод, спользующийся для визуализации нативной ДНК и ее фрагментов различного происхождения (геномная ДНК, ДНК плазмид, продукты рестрикции, ПЦР-продукты). Во всех указанных случаях нужно было увидеть результат производимых манипуляций с ДНК, охарактеризованной поэлектрофоретической подвижности. Однако имеется и другая область приложения метода электрофореза — очистка определеннойфракции полинуклеотидов, или препаративный электрофорез.
Принципиально препаративный электрофорез не отличается от аналитического, основное требование к нему — доступность носителя (геля) для последующего извлечения из него целевого полинуклеотида. Для наибольшей продуктивности электрофореза используемая пластина агарозного или полиакриламидного геля должна быть относительно крупного размера и по своим механическим свойствам удобна для разрезания, измельчения или растворения.
Полиакриламидный гель как носитель для электрофореза нуклеиновых кислот по аналитическим характеристикам значительнопревосходит агарозный, обладая большим разрешением (до одного нуклеотида, у агарозного — 10 и более нуклеотидов) и широким диапазоном плотностей, используемых для самых разных целей.Однако полиакриламид — химически инертный материал и почтине растворяется ни в одном из известных растворителей. Растворить ПААГ можно в концентрированном пероксиде водорода, однако при этом неизбежно разрушение ДНК, РНК и белков. Этот прием применим только для очистки стеклянных трубок или пластин от примесей геля; остающегося на их стенках послеокончанияработы. Извлечение (элюция) ДНК путем простой диффузии из крупного блока полиакриламидного геля — длительный и малоэффективный процесс, хотя его можно несколько усовершенствовать, например при подключении электрического тока (электродиффузия). Тем не менее полностью извлечь из ПААГ фракционированный целевой фрагмент можно только после механического разрушения геля, а это недопустимо в случае разделения длинных молекул ДНК, так как они также могут быть разрушены.
Фракционирование нуклеиновых кислот методом электрофореза в ПААГ все же применяют:
для разделения и очистки (препаративного разделения) коротких олигонуклеотидов, например химически синтезированных праймеров и зондов для ПЦР с детекцией продукта в реальном времени (геа1-time РСR) или гибридизации;для непрерывного фракционирования (в отличие от стационарного), осуществляемого подобно хроматографии, однако в этом случае продукты детектируют не на выходе, а в толще носителя на определенном участке гелевого блока по ходу электрофореза. При этом гелевая камера чаще всего имеет вид капилляра с отводным каналом, расположенным напротив окошка детектора, и, как только истечет определенное время электрофореза («время удержания») для целевого фрагмента в геле, направление движения фрагмента меняют на боковое путем переключения электрических контактов (рис. 8).

Агарозный гель более удобен в качестве носителя для препаративного электрофореза, так как для проведения этого вида электрофореза не требуется специального оборудования (может бытьиспользована камера для горизонтального аналитического электрофореза). Для окрашивания нуклеиновых кислот чаще всего используют интеркалирующие красители, такие как бромистый эдидий или более чувствительный SYBR Green, которые флуоресцируют в УФ-свете. Наблюдать за ходом электрофореза можно визуально, периодически помещая гель на светофильтр трансиллюминатора и фиксируя таким образом момент, когда целевой фрагмент в достаточной степени отделится от остальных фракций. Как только это произойдет, участок агарозного геля, содержащий целевой фрагмент, необходимо вырезать из гелевой пластины. Для элюции целевого фрагмента ДНК вырезанный участок агарозного геля можно расплавить (нуклеиновые кислоты при этом обычно не разрушаются, кроме того, можно использовать и сорта легкоплавкой агарозы) или растворить, например, в концентрированном растворе гуанидинтиоцианата, а затем извлечь целевой фрагмент из раствора с помощью одного из методов выделения ДНК.
Чтобы уменьшить потери на этом этапе, для связывания нуклеиновых кислот используют сорбент на основе оксида кремния (SiO2) или в виде водной суспензии (так называемое стеклянное молоко или glass milk), или нанесенный на поверхность полупроницаемой мембраны. Электрофорез в агарозном геле непригоден для разделения коротких олигонуклеотидов, а элюция с использованием сорбентов в этом случае малоэффективна и приводит к значительным потерям.
Таким образом, большинство задач, связанных с очисткой нуклеиновых кислот, можно решить методом препаративного электрофореза, подобрав соответствующие условия, а указанные особенности наиболее доступных носителей дополняют друг друга и расширяют возможности эксперимента.
Препаративный электрофорез очень часто используется для очистки нуклеиновых кислот, особенно ДНК, поэтому для элюции ДНК из агарозного геля теперь производится целый ряд коммерческих наборов реагентов. Использование таких наборов обеспечивает минимальные потери и высокое качество элюированной нуклеиновой кислоты с минимальными затратами времени.
Например, набор реагентов Diatom™ DNA Elution (ООО «КОМПАНИЯ «БИОКОМ») позволяет очистить ДНК после ее сорбции на суспендированных частицах SiO2 (в данном случае — NucleoS™-сорбент) из раствора, полученного при растворении агарозного геля в 3,5—4,0 М растворе гуанидинтиоцианата (в данном случае — солюбилизирующий раствор).
Последующую очистку ДНК, связанной с сорбентом, от возможных сопутствующих примесей производят спиртовым раствором ацетата калия (рабочий раствор солевого буфера),и,наконец,отделение фрагментов ДНК от частиц сорбента (растворение, элюция) наиболее полно обеспечивается суспензией ионообменных смол. ЭкстраГен™Е,который можно заменить стерильной деионизованной водой или ТЕ-буфером, однако потери ДНК при элюции будут выше на 15—20 %.
Набор реагентов Diatom™ DNA Elution особенно эффективен для элюции фрагментов ДНК размером от 200 до 20 000 п.н. и обеспечивает высокую чистоту выделенной ДНК (А260/A280=1,6 2). Очищенная ДНК может быть использована для практически любых генно-инженерных исследований, в том числе для прямого секвенирования. Потери ДНК составляют не более 20 %.
Цель работы. Произвести очистку ПЦР-фрагмента ДНК методом препаративного электрофореза в агарозном геле с последующей элюцией ДНК на суспендированном сорбенте.
Оборудование и материалы. 1. Термостат твердотельный для микропробирок вместимостью 1,5 мл. 2. Микроцентрифуга до 5000 g для микропробирок вместимостью 1,5 мл. 3. Микроцентрифуга-вортекс до 2000g для микропробирок. 4. Оборудование для горизонтального электрофореза ДНК в агарозном геле с трансиллюминатором для детекции. 5. Микропробирки вместимостью 1,5 мл с крышками. 6. Цилиндр мерный вместимостью 250 мл. 7. Раствор неочищенного целевого фрагмента ДНК (можно использовать, например, продукт ПЦР, полученный с ДНК растительного или животного происхождения и специфичными для гена 18S рРНК олигонуклеотидньши праймерами — см. практическую работу № 7). 8. Набор реагентов для элюции ДНК из агарозного геля (например, Diatom™, DNA Elution ООО «КОМПАНИЯ «БИОКОМ»). 9. 96%-ный этанол. 10. Бидистиллированная вода.
Ход работы. Электрофорез продуктов ПЦР. Препаративный электрофорез проводят в тех же условиях, что и аналитический (см. практическую работу № 2), только для получения достаточного количества очищенного фрагмента требуется нанести на гелевую пластину 40—50 мкл ПЦР-смеси (использовать для этого 4—5 лунок и вносить по 10 мкл в каждую). Процесс электрофореза заканчивают, когда пробег фронта краски-лидера составит 3—4 см от линии старта. Периодически можно наблюдать за ходом фракционирования, останавливая процесс электрофореза и помещая гель на светофильтр трансиллюминатора. В процессе препаративного электрофореза целевой фрагмент ДНК отделяется от. неиспользованных нуклеозидтрифосфатов, балластных белков, ДНК-матрицы (остается вблизи старта) и оставшихся праймеров (располагаются вблизи фронта пробега, обозначенного краскойлидером).
Элюция целевого фрагмента ДНК. 1. Помещают гелевую пластину на светофильтр трансиллюминатора, включают УФ-облучение и, наблюдая через защитное стекло (или очки), отмечают расположение целевого фрагмента.
2.Вырезают участки геля, содержащие целевой фрагмент, так, чтобы не захватывать лишний гель и не оставлять ДНК в гелевой пластине, аккуратно помещают вырезанные участки в две микропробирки вместимостью 1,5 мл.
3.Далее, следуя инструкции к набору реагентов Diatom™ DNA ЕLution, готовят рабочий раствор солевого буфера. Для этого содержимое флакона с солевым буфером из комплекта набора переносят в мерный цилиндр, доводят бидистиллированной водой до50 мл, а затем 96%-ным этанолом до 200 мл и перемешивают. Готовый рабочий раствор солевого буфера следует хранить в герметично закрытой посуде при температуре 2—8 °С.
4.К фрагменту геля объемом около 100—200 мкл (по маркировке микропробирки) добавляют 500 мкл солюбилизирующего реагента из комплекта набора. Термостатируют пробирку при 65°С в течение 3—5 мин, при этом гель должен полностью раствориться.
5.Добавляют в пробирки по 25 мкл NucleoS+™ и 100 мкл связывающего реагента из комплекта набора. Количество добавляемого сорбента можно варьировать в зависимости от требуемого количества элюируемой ДНК. Для элюции 10 мкг ДНК следует добавить 20 мкл NucleoS+™.
6.Содержимое пробирок суспендируют при переворачивании, выдерживают при комнатной температуре 5—7 мин, переворачивая пробирки несколько раз каждые 1—2 мин. Постоянное переворачивание пробирки на ротаторе способствует максимальной сорбции ДНК с сорбентом Мис1ео§+™ и, следовательно, сводит/V потери ДНК к минимуму.
7.Центрифугируют пробирки 10 с при 5000g, супернатант полностью удаляют.
8.Добавляют к осадку 1 мл рабочего раствора солевого буфера. Содержимое пробирки встряхивают на вортексе 5—10 с до гомогенного состояния.
Внимание! Если суспендирование осадка затруднено из-за сильного слипания частиц сорбента (при высоком содержании ДНК), рекомендуется осторожное пипетирование осадка с последующим встряхиванием на вортексе до гомогенного состояния. '-»
9.Центрифугируют пробирки 10 с при 5000g, супернатант полностью удаляют, Повторяют пп. 7—9.
10.Подсушивают осадок в пробирке 4—5 мин, поместив ее в термостат на 65 °С и открыв крышку.
11.Добавляют к осадку 100 мкл ЭкстраГенаЕ™. Внимание! ЭкстраГен Е™ следует предварительно встряхнуть и
затем отбирать от общего объема при постоянном перемешивании (пипетировании).
12.Суспендируют содержимое пробирки на вортексе 5—10 с до получения гомогенной суспензии, термостатируют 4—5 мин при 65°С. На этом этапе работы происходит элюция: ДНК, связанная с сорбентом, переходит в раствор. Еще раз суспендируют содержимое пробирки на вортексе и центрифугируют 2 мин при 10 000 g.
13.Супернатант (раствор очищенной ДНК) отбирают и переносят в чистую микропробирку.
Хранят образец очищенной ДНК при —18°С, если не предполагается частое размораживание, в противном случае — при 2—8 °С.
Контрольные вопросы. 1. Как происходит разделение фрагментов ДНК в электрическом поле? На каком принципе основан электрофорез нуклеиновых кислот? 2. Каково устройство камеры для горизонтального электрофореза нуклеиновых кислот? Как следует подключать электроды к источнику постоянного напряжения? 3. Почему агарозный гель малопригоден для фракционирования фрагментов ДНК размером менее 50 п.н.? 4. Каковы основные этапы процесса очистки ДНК представленным методом? В чем сущность каждого этапа?
Задания.1. Очистить ПЦР-фрагмент ДНК гена 18S рРНК. 2. Определить концентрацию ДНК в очищенном фрагменте.
