
- •Содержание
- •Методы удаления из воды веществ 3 группы
- •Б) при вводе перед фильтрами при двухступенчатой очистке доза паа равна 0,05—0,1 мг/л, доза ак — 0,2—0,5 мг/л;
- •Расчет дозы кислоты в виде товарного продукта Дк, мг/л, производится по формуле
- •7.5J.2. Обесцвечивание и дезодорация, обезжелезивание и демаиганация воды
- •Применение других окислителей в технологии обработки воды
- •Применение восстановителей в технологии обработки воды
- •Дехлорирование воды
- •Обескислороживание воды
- •Методы умягчения воды
- •Общие сведения
- •Реагентные методы умягчения воды
- •Расчет доз реагентов
- •Умягчение воды методом катионного обмена
- •Основные требования к методам обработки воды для оборотных и замкнутых циклов водоснабжения
- •Общие сведения
- •Методы борьбы с цветением воды и биологическим обрастанием оборудования
- •Умягчение Обеззараживание
- •1. Анализ исходных данных, выбор схемы и состава сооружений водоподготовки
- •Сравнение показателей качества воды в источниках водоснабжения с требованиями предъявляемыми к воде питьевого назначения позволяет выбрать необходимые виды водоподготовки.
- •Расчет сооружений реагентного хозяйства
- •2.1. Определение расчетной производительности станции водоподготовки
- •2.2. Определение доз реагентов
- •2.2.1. Определение дозы коагулянта
- •Определение дозы подщелачивающего реагента
- •4.2. Применение флокулянтов
- •4.3. Хранение, приготовление растворов и дозирование реагентов
- •4.3.2. Отделение приготовления коагулянта
- •4.3.3. Отделение приготовления щелочных реагентов
- •4.3.4. Отделение приготовления флокулянтов
- •Технические характеристики мешалки для приготовления раствора флокулянта
- •2.3. Расчет сооружений для хранения, приготовления рабочего раствора и дозирования коагулянта
- •Расчет баков-хранилищ
- •2.3.2. Расходные баки
- •2.3.3. Дозирование коагулянта в обрабатываемую воду
- •2.3.4. Подбор воздуходувов
- •Смесители
- •4. Камеры хлопьеобразования и отстойники
- •4.1. Вертикальные отстойники
- •5.Скорые фильтры
- •6. Обеззараживание воды
- •Оборот промывных вод от фильтров
- •Расчет коммуникационных трубопроводов и построение высотой схемы сооружений
- •Расчет коммуникационных трубопроводов
- •Построение высотной схемы сооружений
- •Заключение
Расчет дозы кислоты в виде товарного продукта Дк, мг/л, производится по формуле
![]()
где Щ0 — щелочность воды до стабилизационной обработки, мг * экв/л;
ек — эквивалент кислоты (для серной —49, соляной —36,5);
Ск— содержание кислоты в товарном продукте, %;
α — коэффициент, зависящий от pH воды и индекса ее насыщения (определяется по графику, приведенному на рис. 7.9).
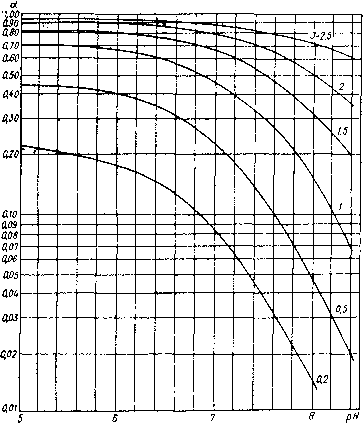
Рис. 7.9. График для определения вспомогательного коэффициента α при определении дозы кислоты.
Стабилизационная обработка воды для предотвращения коррозии трубопроводов
При использовании вод открытых водоемов для водоснабжения требуется применять повышенные дозы реагентов, что неизбежно усиливает ее коррозионные свойства. Увеличение агрессивного действия воды при очистке объясняется нарушением в ней углекислотного равновесия, так как при добавлении в воду I мг сульфата алюминия или хлорида железа (III) выделяется около 0,8 мг свободной углекислоты за счет разложения гидрокарбонатов. Вода становится нестабильной, т. е. способной растворять защитные пленки на внутренней поверхности трубопроводов в результате появления в ней агрессивной углекислоты. При оголении поверхности трубопроводов усиливается электрохимическая коррозия, которой благоприятствует растворенный в воде кислород. Вода обогащается продуктами коррозии, обусловливающими ухудшение ее качественных показателей.
При расчете дозы извести (оксида кальция) для стабилизационной обработки воды возможны два случая, определяемые по значениям рН0 (для исходной воды) и pH., (для воды с индексом насыщения J = 0): рН0 < pHs < 8,4 н рНо <8,4 < pHs. Формулы для определения дозы извести в этих случаях следующие:
![]()
где β — коэффициент, определяемый по графику на рис. 7.10, а; χ и ε - коэффициенты, определяемые по графику на рис. 7.10, б.
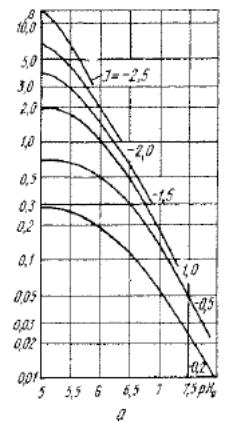
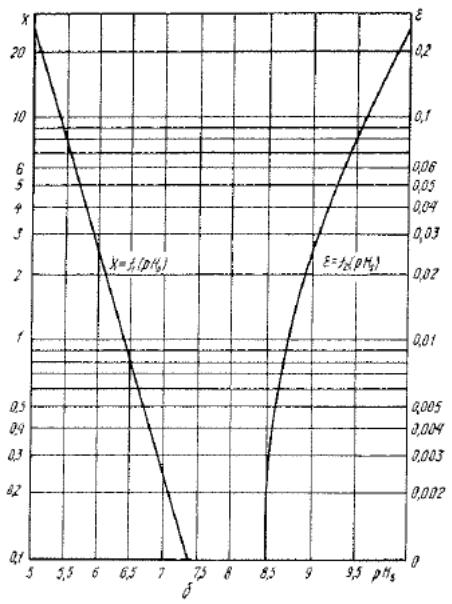
Рис. 7.10. Графики для определения коэффициентов β (а), χ и ε (б).
Вычисленную величину сравнивают со значением, полученным из выражения для дозы извести, рассчитанной на суммарное содержание в воде углекислоты и гидрокарбонатов:
![]()
где (С02) — содержание углекислоты в воде, мг/л. Если Ди > Ди°, то в обрабатываемой воде недостаточно карбонатных соединений; поэтому одновременно с известью (Ди°) в воду необходимо вводить соду (карбонат натрия), дозу которой определяют по формуле
Д с = 53 (Да — Дн°)/28,
Для периодического наращивания защитной пленки карбоната кальция на внутренней поверхности трубопроводов необходимо повышать индекс стабильности обрабатываемой воды до значения J = +0,7. Дозы извести в этом случае определяют по следующим формулам:
при pHs < 7,7 Ди°= 28т1 (СОа);
прн pHs > 7,7 Ди° =28т2 (С02) + 28т3 [Щ + т2 (С02)],
где т1, —коэффициент, зависящий от значения индекса насыщения и отношения (С02)/Щ (находится по графику на рис. 7,11, а); т2 — коэффициент, зависящий от значения рН0 н отношения (СО2)/Щ (находится по графику на рис. 7.11,6); т3 — коэффициент, зависящий от значения pHs (находится по графику на рис, 7.11, в).
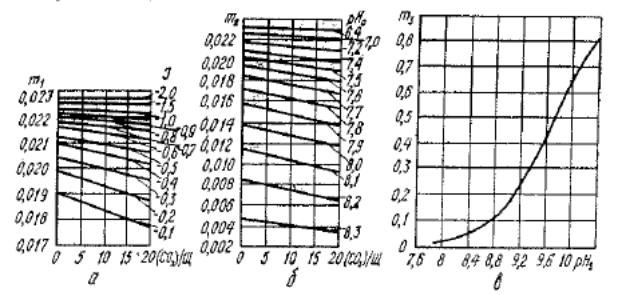
Рис. 7.11. Графики для определения коэффициентов т1 (а), т2 (б) и т3 ( в).
В приведенных формулах дозы извести определяются в миллиграммах СаО на литр. Для пересчета их на массу технического продукта используется зависимость
Д = ДИ> 100/С,
где С — содержание СаО в техническом продукте, %,
Стабилизация воды, содержащей агрессивную углекислоту (индекс насыщения J < 0), может осуществляться фильтрованием ее в открытых безнапорных фильтрах через мраморную крошку (СаСО3), полуобожженный доломит — магно-массу (СаСО3 • MgO) или обожженный магнезит (MgO), Преимуществом данного метода стабилизационной обработки воды является автоматическая работа фильтров, так как при контакте этих активных масс с агрессивной водой в ней самопроизвольно устанавливается углекислотное равновесие. Для малых водопроводных станций такой способ удобен, так как не требует контроля процесса и сложного оборудования известкового хозяйства. Недостатком метода является замедление скорости реакции при низких температурах воды, а также невозможность получить воду с положительным индексом насыщения (J = +0,7) для создания защитной карбонатной пленки на поверхности трубопроводов.
Для загрузки фильтров применяют крошку перечисленных выше материалов с размером частиц 0,5—3 мм при слое высотой до 2 м. Скорость фильтрования воды через мраморную крошку до 10 м/ч, через магно-массу — 10 м/ч; она зависит от температуры и щелочности воды, а также от концентрации в ней агрессивной углекислоты. Фильтрующий слой промывается восходящим потоком воды с интенсивностью 15л/(м2 . с) в течение 10—15 мин;
при водовоздушной промывке интенсивность подачи воздуха составляет 20—25 л/(м2 . с) в течение 5 мин с последующей промывкой водой с интенсивностью 3—4 л/(м2 . с) на протяжении 2—3 мин. В поступающей на фильтры воде содержание железа не должно превышать 0.5 мг/л, так как при большей его концентрации наблюдается цементирование зерен фильтрующей загрузки. Периодически фильтры догружают зернистым активным материалом, пополняя его расход на стабилизационную обработку воды; для связывания 1 мг агрессивной углекислоты расходуется 2,3 мг мрамора или 1,1 мг магно-массы. Иногда в фильтрующем слое используют мраморную крошку в смеси с песком. Такие фильтры комбинированного действия могут быть использованы для одновременного осветления воды и стабилизации ее состава.
ОБРАБОТКА ВОДЫ ОКИСЛИТЕЛЯМИ
Хлорирование воды
Обеззараживание воды
При хлорировании воду обрабатывают газообразным хлором или препаратами, содержащими хлор — гипохлоритом кальция или натрия, хлорной известью, оксидом хлора (IV), хлораминами.
Введенный в воду газообразный хлор гидролизуется, образуя гипохлоритную и соляную кислоты:
![]()
Прн различных значениях pH соотношения между концентрациями хлора С12. недиссоциированной гипохлоритной кислоты НСЮ и гипохлоритного нона СЮ- в воде представлены на рис. 7.12, а, откуда видно, что при pH 7—8 главным дезинфицирующим соединением является гипохлоритная кислота.
Если в воде присутствуют аммиак, аммонийные соли или органические вещества, содержащие аминогруппы, в реакцию с ними вступают хлор, гипохлоритная кислота и гипохлориты, образуя моно- и дихлорамины:
![]()
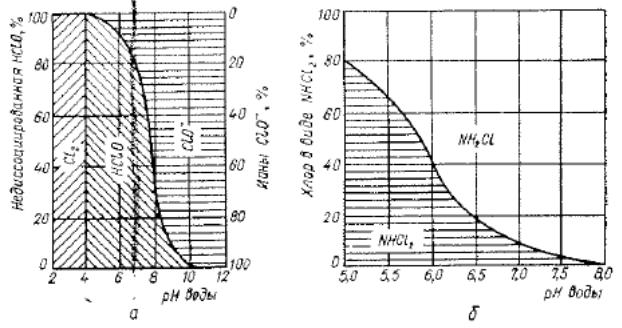
Рис. 7.12. Соединения хлора при различных pH среда в отсутствие (а) и в присутствии (б) аммиака.
Бактерицидность хлора в воде уменьшается с повышением pH. Поэтому воду следует обеззараживать хлором до введения в нее щелочных реагентов.
В случае присутствия в воде органических соединений, способных окисляться, или восстановителей, а также коллоидных и взвешенных веществ, которые могут обволакивать бактерии, процесс обеззараживания воды замедляется.
Коли-индекс природной воды обычно не превышает 1000—10 ООО кл./л. Концентрация остаточного хлора 0,5 мг/л при времени контакта 30 мин, как правило, обеспечивает удовлетворение санитарных требований, предъявляемых к бактериологическому качеству воды. В случае хлорирования с аммонизацией время контакта должно быть увеличено до 1 ч. Такое же время контакта принимают и при обработке воды хлорной известью, а совместно с аммиаком — 1,5 ч.
Для приближенной оценки количества хлора, необходимого для обеззараживания воды поверхностных источников, принимают дозу 2—3 мг/л, а для воды подземных источников — 0,7 —1,0 мг/л.
Одним из условий обеспечения хороших результатов хлорирования является быстрое и полное перемешивание хлора с водой.
Обесцвечивание воды и улучшение процессов водоподготовки
В природных водах открытых водоемов кроме бактериальных загрязнений имеется значительное количество органических соединений, обусловливающих цветность воды, в основном гуминовых веществ болотного пли почвенного происхождения.
При pH среды 7.5—8, в которой активный хлор находится в виде эквивалентной смеси НСlO- и ClO-, наблюдается максимальная скорость окисления гумпновых веществ и максимальная степень их обесцвечивания.
Установлена эмпирическая формула для расчета обесцвечивания днепровской воды при хлорироввини:
![]()
где Цс — снятая цветность, град;
Ц - цветность исходной воды, град;
С1 — доза хлора, мг/л;
t — время контакта хлора с водой, мни.
Одновременно с обесцвечиванием природной воды под действием хлора наблюдается и снижение ее окисляемости. Объясняется это возникновением соединений, не реагирующих с окислителями, так как при хлорировании воды углекислота не образуется. Т.о., хлорирование гумусовых веществ не является деструктивным процессом и поэтому не может обеспечить такую же глубину обесцвечивания природных вод, которая достигается при озонировании.
Хлорирование воды с аммонизацией
На обеззараживание воды расходуется лишь незначительное количество вводимого в нее хлора; основная масса этого реагента идет на окисление различных органических и неорганических примесей. Для фиксации хлора в воде на более продолжительное время и одновременного снижения его расхода применяют хлорирование с аммонизацией. При наличии в воде аммиака или солен аммония вводимый в нее хлор образует хлорамины, окислительный потенциал которых значительно ниже, чем у свободного хлора. В результате этого резко снижается хлоропоглощаемость воды, а содержащийся в ней после обработки хлораминный хлор органолептически менее ощутим.
Содержание аммиака или аммонийных солей в водах многих поверхностных водоемов и водотоков вследствие протекания в них биологических процессов или в результате загрязнения сточными водами достигает значение 0,5 мг/л и больше.
В зависимости от целевого назначения аммонизацию проводят перед хлорированием воды (преаммонизация) или после него (постаммонизация).
В случае преаммонизации аммиак подается в водоводы первого подъема или в другое место технологической схемы за I—2 мин до первого ввода хлора. Этим предупреждается образование хлорфенольных запахов и привкусов в обрабатываемой воде. При постаммонизации аммиак подается в резервуары чистой воды, чем обусловливается фиксация хлора на более длительное время. Наиболее эффективной является смесь, содержащая аммиак и хлор в молекулярных соотношениях от I : I до I : 2, что примерно соответствует соотношениям по массе от 1:4 до 1:10. Оптимальное соотношение этих реагентов для каждого конкретного образца воды должно устанавливаться на основании пробных хлорирований, проводимых по сезонам года.
Озонирование воды
Обеззараживание воды
Озон по бактерицидному действию имеет ряд преимуществ перед хлором. При изучении действия озона на разные бактерии показано, что существует критическая доза озона (0,4—0,5 мг/'л), выше которой бактерицидное действие его резко возрастает и достигается полное обеззараживание в отличие от хлора, обеззараживающее действие которого при малых концентрациях монотонно возрастает с увеличением дозы реагента.
Обеззараживающий эффект при применении озона сказывается быстрее в 15—20 раз, чем при применении хлора. На аффект обеззараживания воды при озонировании температура и pH среды оказывают меньшее влияние, чем при хлорировании.
Дозы озона и время его контакта с водой изменяются в довольно широких пределах и зависят от качества воды п условий ее обработки. В связи с малой растворимостью озона на процесс обеззараживания оказывает влияние не только его доза, но и другие факторы: концентрация озона в озоновоздушной смеси, способ распределения смеси в воде, высота контактных бассейнов, соотношение объемов воды и озоновоздушной смеси, содержание органических веществ в воде и др. Совокупность этих и других факторов оказывает существенное влияние на эффективность обеззараживания воды озоном. Поэтому объективные данные о его действии на бактериальные загрязнения воды могут быть получены только в том случае, когда опыт проводится в условиях, близких к производственным.
По экономическим соображениям наиболее целесообразно вводить озон в предварительно обработанную коагулянтом и отфильтрованную воду. В этом случае расход озона уменьшается примерно в 2—3 раза, так как большая часть органических соединении и взвешенных веществ, на окисления которых расходуется озон, задерживается очистными сооружениями.
