
- •Лабораторная работа № 1
- •Лабораторная работа № 2 «кондуктометрическое титрование»
- •Общие сведения
- •2. Цель и задачи работы
- •Список литературы
- •Лабораторная работа № 3
- •1. Общие сведения
- •2. Цель и задачи работы
- •3. Порядок выполнения работы
- •Список литературы
- •Лабораторная работа № 4
- •1. Общие сведения
- •2. Цель и задачи работы
- •3. Порядок выполнения работы
- •Список литературы
- •Лабораторная работа № 5
- •Сложного эфира»
- •I. Общие сведения
- •2. Цель и задачи работы
- •3. Порядок выполнения работы
- •Список литературы
- •Лабораторная работа № 6
- •Общие сведения
- •Цель и задачи работы
- •Порядок выполнения работы
- •Содержание
- •Редактор л.А.Матвеева
- •450062, Г.Уфа, ул. Космонавтов, 1. Адрес типографии
- •453118, Г. Стерлитамак, пр. Октября, 2
Список литературы
1. Стромберг А. Г., Семченко Д. П. Физическая химия. - М.: Высшая школа, 1973.
2. Краткий курс физической химии. - М.: Высшая школа, 1978.
3. Физическая химия /Под ред. К.С. Краснова. - М.: Высшая школа, 1982.
4. Практикум по физической химии /Под ред. С.В.Горбачева. - М.: Высшая школа, 1974.
Лабораторная работа № 6
"ИССЛЕДОВАНИЕ ВЛИЯНИЯ КАТАЛИЗАТОРА НА РАЗЛОЖЕНИЕ ПЕРЕКИСИ ВОДОРОДА"
Общие сведения
В обычных условиях перекись водорода самопроизвольно медленно разлагается. Реакция протекает по уравнению
2Н2О2 = 2Н2О + О2 .
В присутствии некоторых веществ (в том числе и твердых) разложение Н202 значительно ускоряется. Следовательно, эта реакция может являться примером гомогенной или гетерогенной каталитической реакции в зависимости от природы катализатора. В данной работе в качестве катализатора используется водный раствор FеС13. Поэтому изучаемая реакция будет гомогенной каталитической реакцией.
Цель и задачи работы
Ознакомиться с одним из методов изучения и основными свойствами гомогенных каталитических реакций. Экспериментально изучить каталитическое влияние FeCl3 на реакцию разложения Н202. Определить каталитическую активность водного раствора FeCI3.
Порядок выполнения работы
Опыты проводят на установке, схема которой представлена на рисунке
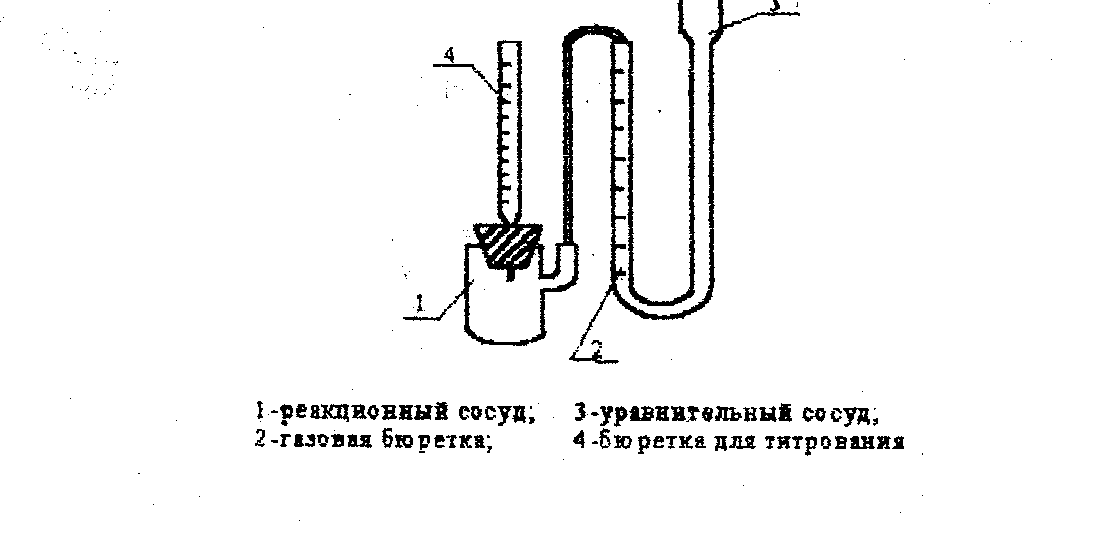
Схема установки
Уравнительный сосуд 3 и бюретку 2 наполняют водой. Уровень воды в бюретке устанавливают на нулевое давление. В реакционный сосуд 1 наливают 25 мл 3%-ного раствора Н202, В бюретку для титрования 4 наливают раствор FеС1з. Реакционный сосуд 1 плотно закрывают резиновой пробкой с укрепленной на ней бюреткой.
Устанавливают уровень воды в газовой бюретке на нуль и замечают время, которое принимают за начало реакции. Замеры делают через определенные промежутки времени (чем выше скорость разложения, тем меньше время между замерами), Объем кислорода измеряют при одинаковых уровнях в уравнительном сосуде и в газовой бюретке.
Реакцию проводят в течение 40 минут при комнатной температуре (нельзя браться руками за реакционный сосуд). Затем проводят реакцию в присутствии 3-х различных порций раствора FeCl3 (количество раствора FeCl3 сообщается преподавателем). В присутствии следующих 2-х порций FeCl3 берут свежие порции раствора H2 02.
ОБРАБОТКА РЕЗУЛЬТАТОВ
За начало реакции принимают 3-й или 4-й замер (т.е. измерение в условиях уже установившегося режима процесса). Определяют интервалы времени от начала реакции до каждого последующего замера (t) и объемы кислорода, выделившегося по истечению этих интервалов (V).
По опытным данным строят графики:
1. Зависимость объема выделившегося 02 от времени.
2. По первому графику определяют количество О2, выделившегося за одно в то же время (для разных интервалов времени) при различных концентрациях FеС13 и строят зависимость количества выделившегося О2 от концентраций FеС13.
3. По второму графику рассчитывают молярную каталитическую активность а, как а =V/m, то есть как приращение скорости реакции, приходящейся на 1 моль FeCl3.
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ
Основные условия опыта Р=1атм. Т =
Катализатор FеСl3 (конц. %) 1- мл., 2- мл., 3- мл.
Количество перекиси водорода 25 мл.
Таблица 1
№ п/п
|
Время на часах
|
Время от начала реакции
|
Уровень жидкости в бюретке
|
Объем выделившегося газа, мл
|
Скорость реакции
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Результаты работы представляются в виде 2-х графиков и таблицы .
КОНТРОЛЬНЫЕ ВОПРОСЫ
Общие свойства катализаторов
Гомогенный катализ и его механизм. Кислотно-основной катализ.
Гетерогенный катализ и его особенности.
Мультиплетная теория Баландина.
Теория активных ансамблей Кобозева.
Электронная теория гетерогенного катализа.
Методика выполнения работы.
СПИСОК ЛИТЕРАТУРЫ
1. Стромберг А. Г., Семченко Д. П. Физическая химия. - М.: Высшая школа, 1973.
2. Краткий курс физической химии. - М.: Высшая школа, 1978.
3. Физическая химия /Под ред. К.С. Краснова. - М.: Высшая школа, 1982.
4. Практикум по физической химии /Под ред. С.В.Горбачева. - М.: Высшая школа, 1974.
5. Быковский В.С. Физическая химия. Часть вторая: Учеб. пособие. – Уфа: Изд-во УГНТУ, 2003.
