
- •Лабораторная работа № 1
- •Лабораторная работа № 2 «кондуктометрическое титрование»
- •Общие сведения
- •2. Цель и задачи работы
- •Список литературы
- •Лабораторная работа № 3
- •1. Общие сведения
- •2. Цель и задачи работы
- •3. Порядок выполнения работы
- •Список литературы
- •Лабораторная работа № 4
- •1. Общие сведения
- •2. Цель и задачи работы
- •3. Порядок выполнения работы
- •Список литературы
- •Лабораторная работа № 5
- •Сложного эфира»
- •I. Общие сведения
- •2. Цель и задачи работы
- •3. Порядок выполнения работы
- •Список литературы
- •Лабораторная работа № 6
- •Общие сведения
- •Цель и задачи работы
- •Порядок выполнения работы
- •Содержание
- •Редактор л.А.Матвеева
- •450062, Г.Уфа, ул. Космонавтов, 1. Адрес типографии
- •453118, Г. Стерлитамак, пр. Октября, 2
Лабораторная работа № 5
«ОПРЕДЕЛЕНИЕ ЭНЕРГИИ АКТИВАЦИИ РЕАКЦИИ ОМЫЛЕНИЯ
Сложного эфира»
I. Общие сведения
В работе изучается скорость реакции между этиловым эфиром уксусной кислоты и едким натром при нескольких температурах. Уравнение реакций
СН3СООС2Н5 + NaOH = CH3COONa + C2H5OH.
Константа равновесия такой реакции выражается уравнением константы скорости реакции второго порядка:
![]()
где а и в - начальные концентрации веществ;
х- количество вещества (моль), прореагировавшего за время t.
Размерность величин стоящих под знаком логарифма может быть любая, так как имеет место их отношение; в работе они будут выражаться в мл щелочи. Разность (а - в) должна быть выражена в грамм-эквивалентах.
Энергия активации реакции вычисляется по формуле

где КТ2 и КТ1 - константы скорости реакции при температуре Т2 и Т1 .
2. Цель и задачи работы
Ознакомиться с изучением кинетики реакции методом отбора проб, определив константы скорости реакции омыления эфира при двух температурах, и вычислить энергию активации реакции.
3. Порядок выполнения работы
Равные объемы растворов щелочи и эфира по 50 мл или по 100 мл в соответствующих сосудах выдерживается в термостате в течение 10-15 минут. После этого растворы быстро смешивают, тщательно взбалтывают и тотчас отбирают пипеткой пробу, не вынимая смеси из термостата. Объем пробы должен равняться приблизительно одной десятой общего объема смеси, т.е. 10(20)мл при общем объеме 100(200)мл. Проба в 10(20) мл вливается в колбочку, содержащую 10(20) мл 0,025Н кислоты. Проводится титрование избыточной кислоты 0,025 Н щелочью в присутствии фенолфталеина до появления розового окрашивания, не исчезающего в течение 30 секунд.
При смешивании равных объемов растворов щелочи и эфира щелочь разбавляется вдвое, и в избытке в первой пробе остается примерно половина взятой кислоты. В последующих пробах этот избыток возрастает, В момент вливания первой пробы в кислоту фиксируется время- это есть время начала реакции, через некоторое время берется вторая проба и тотчас вливается в кислоту. Таким образом, берут и тотчас титруют восемь проб через интервалы времени. Каждый раз при вливании пробы в кислоту записывают, сколько минут прошло от начала реакции к моменту взятия пробы.
Для сокращения времени на титрование в пробу быстро вливают количество щелочи, идущее на предыдущую пробу, затем осторожно по каплям титруют до нужной окраски. Вливание проб в кислоту останавливает реакции щелочного омыления и дает более удобное изменение окраски при титровании (от бесцветного к розовому ).
Конечная проба берется через 3 часа или на следующий день.
4. ОБРАБОТКА РЕЗУЛЬТАТОВ
До начала реакции те же 10 или 20 мл кислоты титру ют непосредственно 0,025 Н щелочью. Разность в числе мл щелочи, пошедшей на непосредственное титрование кислоты и кислоты частично, нейтрализованной взятой пробой (обратное титрование), соответствует щелочности в данный момент.
Обозначим эти значения через а0 для начальной пробы, когда t =0; а- для последующих проб и a - для конечной пробы. Эти значения подставляют в формулу для расчета константы скорости под знак логарифма.
а=ао; (а-х) = аt ;b = а0 - а; (в-х) = аt - а.
5. СХЕМА ЗАПИСИ ОПЫТА
Щелочь 0,025 Н, раствор эфира 0,015 Н до смешивания. Объем отобранной пробы 20 мл. Объем кислоты, взятой на нейтрализацию пробы, 20 мл. Количество щелочи, идущее на непосредственное титрование, -20,2 мл, Т = °С.
Время отбора проб |
Время от начала реакции, мин |
Расчет (а-х) = аt |
Расчет (в-х) = аt - а |
|
10ч 5мин 0 20,2-10,4= 9,8-3,8=6,0
9,8 (а0)
10ч 8мин 3 20,2-11,2= 9,0-3,8=5,2 ё 3,92 м-1 моль-1
9,0 (аt)
10ч 13мин 8 20,2-12,2= 8,0-3,8=4,2 4,04 м-1 моль-1
8,0 (аt)
13ч 5мин 180 20,2-16,4= 3,8-3,8=0
3,8 (а) (эфир израсхо-
дован) Кср.=
Разность (а-в) выражается вэквивалентах. Вычисления а и в по данном опыта проводится следующим образом:
![]()
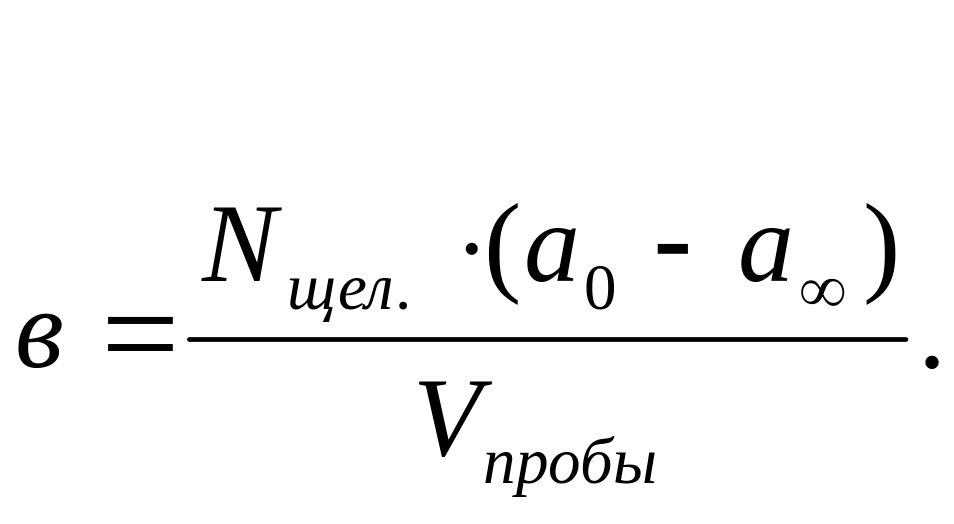
Для данного опыта
а
=
![]() =
0,0122 н; в =
=
0,0122 н; в =
![]() =
0,0075 н.
=
0,0075 н.
Определение константы скорости при данной температуре считается выполненным при условии совпадения 6-7 значений константы, полученных при проведении опыта.
При проведении опыта при нуле градусов термостатом служит смесь воды и льда (снега). Интервал между пробами должен быть таким, чтобы резкость между двумя последовательными титрованиями была не меньше 0,5 и не более 1,0 мл.
Рекомендуемое время отбора проб от начала опыта в минутах:
0° 0 . 10 25 50 80 120 200
25° 0 3 8 15 25 40 70
35° 0 2 5 8 15 30 50
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Зависимость скорости реакции от температуры.
2. Понятие энергии активации и связь между теплотой реакции и энергией активации.
3. Теория активных соударений. Вывод константы скорости.
4. Истолкование мономолекулярных реакций на основе теорий столкновений.
5. Теория переходного состояния.
6. Цепные реакции.
7. Фотохимические реакции.
8. Методика выполнения работы.
