
- •Лабораторная работа № 1
- •Лабораторная работа № 2 «кондуктометрическое титрование»
- •Общие сведения
- •2. Цель и задачи работы
- •Список литературы
- •Лабораторная работа № 3
- •1. Общие сведения
- •2. Цель и задачи работы
- •3. Порядок выполнения работы
- •Список литературы
- •Лабораторная работа № 4
- •1. Общие сведения
- •2. Цель и задачи работы
- •3. Порядок выполнения работы
- •Список литературы
- •Лабораторная работа № 5
- •Сложного эфира»
- •I. Общие сведения
- •2. Цель и задачи работы
- •3. Порядок выполнения работы
- •Список литературы
- •Лабораторная работа № 6
- •Общие сведения
- •Цель и задачи работы
- •Порядок выполнения работы
- •Содержание
- •Редактор л.А.Матвеева
- •450062, Г.Уфа, ул. Космонавтов, 1. Адрес типографии
- •453118, Г. Стерлитамак, пр. Октября, 2
Лабораторная работа № 1
"ОПРЕДЕЛЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРА ЭЛЕКТРОЛИТА"
1.ОБЩИЕ СВЕДЕНИЯ
В электролитах электрический ток является следствием движения ионов в электрическом поле. Электропроводность слабых электролитов определяется в основном степенью диссоциации, которая зависит от концентрации электролита и температуры. Измерения электропроводности слабых электролитов позволяют определить величины констант диссоциации, по которым можно рассчитывать термодинамические функции.
2. ЦЕЛЬ И ЗАДАЧИ РАБОТЫ
Ознакомиться с классическим методом определения электрической проводимости раствора электролита и степени диссоциации растворенного вещества. Определить удельную электропроводность уксусной кислоты различных концентраций. На основании полученных экспериментальных данных вычислить эквивалентную электропроводность, степень электролитической диссоциации, константу диссоциации уксусной кислоты.
3. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
В основе методики измерения электропроводности лежит способ Кольрауша с применением схемы мостика Уитстона (рис.1).
.
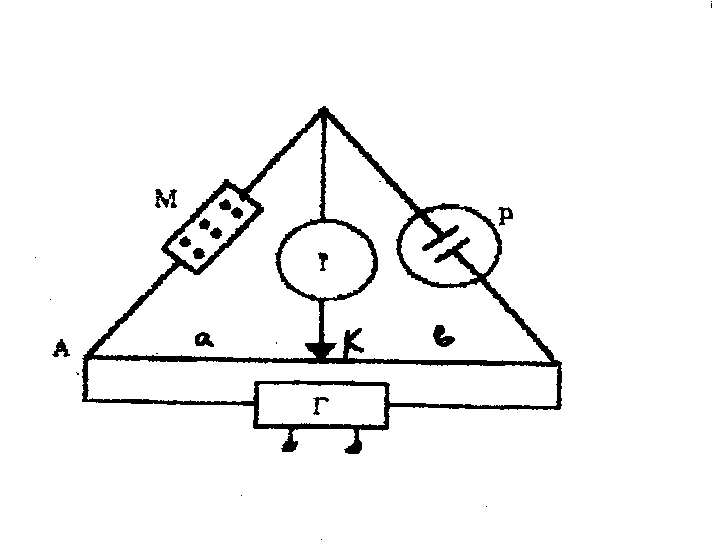
Рис. 1. Схема установки:
АС - измерительная проволока;
а и в - плечи мостика;
К - подвижный контакт;
Т-телефон;
Г-генератор;
М-магазин сопротивлений;
Р- сосуд с раствором электролита
Собрав установку и проверив контакты, наливают в сосуд такое количество стандартного раствора (0.02Н раствора КСl), чтобы электроды были полностью погружены в раствор. Включают генератор в сеть. Подбирают такое сопротивление магазина, чтобы при положении подвижного контакта примерно по середине измерительной проволоки звук в телефоне стал минимальным; величину сопротивления и длины плеч записывают. Затем уменьшают сопротивление магазина на 10-20 % и перемещают контакт до положения, соответствующего минимальному звуку телефона. То же повторяют при увеличении сопротивления магазина.
Заменяют стандартный раствор на заданный исследуемый раствор слабого электролита, предварительно ополоснув им ячейку, и при трех различных положениях контакта измеряют сопротивление. Замеры повторяют также после 2-х и четырехкратного разбавления исследуемого раствора.
4. ОБРАБОТКА РЕЗУЛЬТАТОВ
4.1. Вычисляют сопротивление (Rx) стандартного и исследуемых растворов при различной концентрации по формуле
Rx = RM , Ом.
4.2. Вычисляют константу прибора (П)
П = ХKCl RKCl .
Удельную электропроводность стандартного раствора (ХKCl) в интервале температур (t) от 15 до 25 0 С можно вычислить по формуле
ХКСl = 0,00250(1-0,021(t-20)), Ом-1см-1.
Вычисляют удельную электропроводность исследуемого раствора (Хр) различной концентрации:
Хр = П/Rp, Ом-1 см-1.
Вычисляют эквивалентную электропроводность исследуемого раствора () различной концентрации (с, г-экв/л):
= Х Ом-1 см2 г-экв-1.
Вычисляют степень диссоциации исследуемого электролита () при различной концентрации раствора:
= ,
где - эквивалентная электропроводность при бесконечном разведении, равная сумме предельных подвижностей ионов (см. справочник К.П.Мищенко).
Вычисляют константу диссоциации электролита
![]() .
.
Экспериментальные и расчетные величины заносят в таблицу.
Таблица 1
Раствор |
RM/a |
RP, Ом |
|||||
|
Замеры |
||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
Среднее |
KCl, 0,02H |
|
|
|
|
|
|
|
Исследуемый с |
|
|
|
|
|
|
|
-«- с/2 |
|
|
|
|
|
|
|
-« - с/4 |
|
|
|
|
|
|
|
Таблица 2
Концентрация исследуемого раствора |
(RP)ср |
ХР |
|
|
К |
с |
|
|
|
|
|
с/2 |
|
|
|
|
|
с/4 |
|
|
|
|
|
По данным табл.2 строят графики зависимости Х от с, от с, от С.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Общие сведения о растворах электролитов.
Теория слабых электролитов Аррениуса.
Теория сильных электролитов Дебая и Гюккеля.
Удельная и эквивалентная электропроводности.
Зависимость электропроводности сильных и слабых электролитов от концентрации.
Принцип измерения сопротивления растворов электролитов.
Постоянная сосуда и ее определение.
Методика выполнения работы.
СПИСОК ЛИТЕРАТУРЫ
1. Стромберг А. Г., Семченко Д. П. Физическая химия. - М.: Высшая школа, 1973.
2. Краткий курс физической химии. - М.: Высшая школа, 1978.
3. Физическая химия /Под ред. К.С. Краснова. - М.: Высшая школа, 1982.
4. Практикум по физической химии /Под ред. С.В.Горбачева. - М.: Высшая школа, 1974.
5. Быковский В.С. Физическая химия. Часть вторая: Учеб. пособие. – Уфа: Изд-во УГНТУ, 2003.
