
- •Вариант 1
- •Определение моментов инерции твердых тел и проверка теоремы гюйгенса - штейнера с помощью трифилярного подвеса
- •Описание рабочей установки и метода измерения
- •Экспериментальная часть
- •Определите момент инерции тел: диска, бруска (рис. 6.6).
- •Контрольные вопросы и задания
- •Вариант 2
- •Описание метода измерения
- •Описание экспериментальной установки
- •5.3. Экспериментальная часть
- •6.2.Ход работы
- •Обработка результатов измерений
- •Цель работы
- •Приборы и принадлежности
- •Теоретическая часть
- •Сложение взаимно-перпендикулярных колебаний
- •Графический метод сложения взаимно-перпендикулярных колебаний
- •Фигуры Лиссажу
- •Порядок выполнения работы
- •Цель работы
- •Теоретическая часть
- •4.Экспериментальная часть
- •1.Установите нужное значение коэффициента затухания . Для этого ползунок, отвечающий за установку коэффициента затухания, совместите с первой меткой .
- •1.Цель работы
- •2.Приборы и принадлежности
- •3.Теоретическая часть
- •Коэффициент вязкости [10-6, Па с] при разных температурах для разных веществ
- •Выталкивающая архимедова сила
- •Сила сопротивления жидкости Fсопр
- •Цель работы
- •Приборы и принадлежности
- •Теоретическая часть
- •3.1.Статистический метод описания систем с очень большим числом частиц
- •3.2.Распределение Максвелла молекул идеального газа по скоростям теплового движения
- •3.3.Распределение молекул по скоростям с учетом направлений (для работы на механической модели) Описание опыта Штерна
- •Подставляя d и в (12.13), найдем:
- •Ход работы на механической модели
- •4 Рис. 12.5. Экспериментальная установка .1.Описание установки
- •4.2.Ход работы
- •5.Ход выполнения работы на компьютере
- •4.Определите наиболее вероятную, среднюю арифметическую и среднюю квадратичную скорости молекул, а также среднюю кинетическую энергию молекул.
- •5.Проделайте опыт для других температур.
- •6.Постройте экспериментальные гистограммы.
- •1. Цель работы
- •Приборы и принадлежности
- •Теоретическая часть
- •Распределение Больцмана
- •Распределение Больцмана и опыт Перрена
- •Ход работы
- •Выбрать жидкость и ввести температуру (по заданию преподавателя).
- •2. Убедиться, что высота равна нулю, и пересчитать число частиц в поле зрения микроскопа на нулевой высоте (рис. 13.3).
- •9.Вычислить средний размер частиц.
- •10.Построить график зависимости п(п) от высоты, выбрав масштаб на координатных осях так, чтобы график занимал всю площадь листа
- •Цель работы
- •Приборы и принадлежности
- •Теоретическая часть
- •Математическая теория броуновского движения
- •Ход работы
- •Выбрать жидкость (по указанию преподавателя).
- •Проделать опыт 20 раз при выдержке 20 секунд.
- •Цель работы
- •Теоретическая часть
- •3.2.Фазовые переходы
- •3.3.Уравнение состояния идеального газа. Теория идеальных газов
- •3.4.Теория реальных газов. Уравнение Ван-дер-Ваальса. Теоретические изотермы
- •Константы Ван-дер-Ваальса для различных газов
- •Для одного моля газа уравнение (16.2) принимает вид
- •Уравнение было получено из модельных представлений о свойствах реальных газов и жидкостей, а не явилось результатом эмпирического подбора функции f(p,V,t), описывающей свойства реальных газов.
- •Уравнение долго рассматривалось как некоторый общий вид уравнения состояния реальных газов, на основе которого было построено много других уравнений состояния.
- •С помощью уравнения Ван-дер-Ваальса впервые удалось описать явление перехода газа в жидкость, а также проанализировать критические явления.
- •Молекулярно-кинетическая теория и фазовый переход пар-жидкость
- •3.6.Уравнение Клапейрона - Клаузиуса
- •Порядок выполнения работы
3.6.Уравнение Клапейрона - Клаузиуса
Из молекулярно-кинетической теории известно, что атомы или молекулы в жидкостях и газах находятся в состоянии постоянного движения. Время от времени отдельные молекулы жидкости, движущиеся достаточно быстро, могут «срываться» с ее поверхности. Таким образом, над любой жидкостью какое- то количество молекул данного вещества будет находиться в виде пара. Давление этих молекул, если нет посторонних примесей, называется давлением пара этого вещества.
Ранее уже было отмечено, что для перевода вещества из жидкого состояния в газообразное нужно затратить некоторую энергию (см. подразд. 2.2). Эта энергия называется теплотой испарения или теплотой парообразования. Уравнение Клапейрона - Клаузиуса описывает отношение между теплотой испарения Н, давлением пара р и температурой вещества Т при равновесно протекающем процессе:
H
= T
 (V2
– V1), (16.14)
(V2
– V1), (16.14)
где Т - температура перехода (процесс изотермический), К; dp/dT - производная давления по температуре на кривой фазового равновесия; V1 и V2 - удельные объемы вещества в исходной и конечной фазах соответственно.
Э
Напомним, что кoэффициент полезного действия (КПД) для тепловой машины
 ,
,
где Q - количество теплоты, сообщенное двигателю; А - работа, произведенная двигателем. Для нашего случая КПД цикла
 =
=
 (V2
-V1)
(16.15)
(V2
-V1)
(16.15)
где
 - удельная
теплота, сообщаемая единице массы
системы при расширении; V1
и
V2
-
удельные объемы фазы 1
и 2, т. е. объемы единицы массы, м3
/кг.
С другой стороны, для цикла Карно КПД
тепловой машины равен
- удельная
теплота, сообщаемая единице массы
системы при расширении; V1
и
V2
-
удельные объемы фазы 1
и 2, т. е. объемы единицы массы, м3
/кг.
С другой стороны, для цикла Карно КПД
тепловой машины равен
 (16.16)
(16.16)
где Т1 - температура нагревателя; Т2 - температура холодильника. Поэтому в нашем случае (рис. 16.7) применение формулы (16.16) для расчета КПД даст выражение
 =
=
 . (16.17)
. (16.17)
В выражении (16.17) величиной dT в знаменателе, в силу ее малости, мы пренебрегаем. Из равенства правых частей уравнений (16.15) и (16.17) следует, что
=
 .
(16.18)
.
(16.18)
Полагая, что Q12 - удельная теплота, сообщаемая системе, равна удельной теплоте испарения Н, можно прийти к уравнению (16.14).
Порядок выполнения работы
В данной работе на экране компьютера имитируется сжатие различных веществ под поршнем в цилиндре. В результате сжатия происходит изменение агрегатного состояния вещества из газообразного в жидкое. В ходе опыта должны быть измерены объёмы вещества в жидком и газообразном состоянии, и давление насыщенного пара при каждой температуре. Для того чтобы выполнить задания виртуальной физической лабораторной работы, необходимо запустить программу, щелкнув левой клавишей мышки на экране (папка «Физ. лаб.»). После этого на экране появится окно, в котором находится список лабораторных работ. Установить курсор в разделе «Молекулярная физика» на работе «Изучение фазового перехода испарение - конденсация» и мышкой активизировать работу программы. В результате появляется окно, в котором присутствует таблица с командами:
О работе
Ход работы
Эксперимент.
Последовательно вызывая пункты меню в таблице, необходимо предварительно ознакомиться с лабораторной работой и порядком ее выполнения.
После обращения к команде Эксперимент появляется окно, где задаются начальные условия виртуального эксперимента (рис. 16.8).
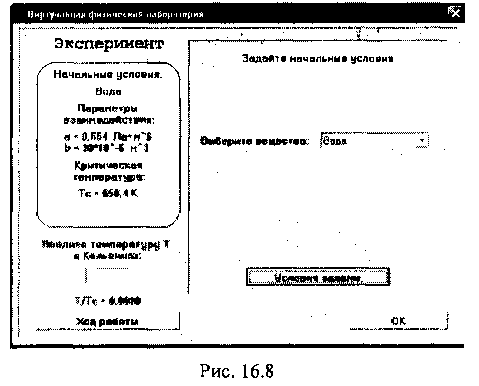
Для выполнения работы необходимо выполнить следующие действия:
Выбрать вещество. Для выбора вещества в соответствующем окне с его названием нужно нажать левую кнопку мыши. Появится список возможных вариантов. Из этого списка нужно выбрать необходимое для опыта вещество, при этом его параметры взаимодействия и критическая температура отобразятся в окне «Начальные условия». Выбрав рабочее вещество, нажать кнопку «Условия заданы». После нажатия кнопки «Условия заданы» появляется окно (рис. 16.8), на котором моделируется процесс фазового перехода из одного агрегатного состояния в другое: газ-жидкость.
При температуре, равной 0,8 от критической (T/Tc измерить объёмы V1 и V2. Убедиться, что температура равна 0,8 от критической. Затем, меняя объём газа в цилиндре, отметить и записать значения объёмов V1 и V2, при которых появляется жидкость, занимая весь объем. Объём газа в цилиндре можно изменить с помощью «ползунка», перемещая поршень вверх или вниз при нажатой левой кнопке мыши.
Измерить давление насыщенного пара при данной температуре. Сначала, при уменьшении объёма газа, его давление растет. Затем, как только в цилиндре появляется жидкость, давление газа некоторое время остается постоянным. При этом давлении (давлении насыщенного пара) жидкость и газ (пар) находятся в состоянии термодинамического равновесия (число молекул, вылетающих из жидкости в пар, равно числу молекул, влетающих из пара в жидкость): они имеют одинаковые значения температуры и давления. Когда весь газ полностью перейдёт в жидкость, дальнейшее уменьшение объёма вызывает резкий рост давления.
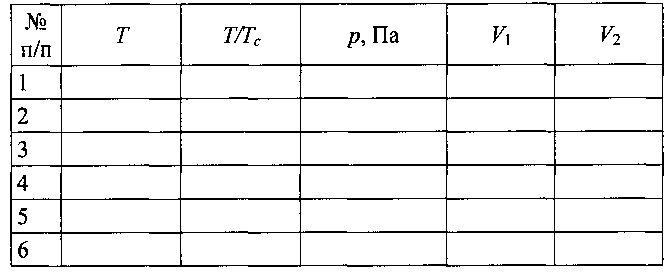
4.Опыт проделать при 6-8 различных значениях температуры. Температуру можно задать путём введения соответствующего числа в предназначенное для этого окно. Опыт следует проделать для значений температуры в интервале от 0,80 до 0,99 от критической и при температуре, несколько выше критической. Температуру, давление насыщенного пара и оба значения объёмов записать в табл. 16.3.
5.Построить область двухфазного равновесия в переменных давление - объём. По оси ординат графика отложить приведенную температуру (Т/Тс), а по оси абсцисс - значения объёмов V1 и V2, соответствующие данной температуре.
6.Построить график зависимости давления насыщенного пара от температуры. По полученному графику оценить наклон кривой при трёх значениях температуры. Для этого необходимо построить касательные к графику в соответствующих точках и определить тангенс угла наклона данной касательной.
Таблица 16.3
7.Оценить скрытую теплоту перехода с помощью уравнения Клапейрона-Клаузиуса по формуле (16.14). Оценить скрытую теплоту перехода при трёх выбранных ранее температурах, принимая, что производная dP/dT равна тангенсу угла наклона касательной. Сделать вывод на основании полученных результатов.
Контрольные вопросы и задания
Сформулируйте цель работы.
Что такое агрегатное состояние вещества? Выделите главные отличительные признаки агрегатных состояний.
Дайте определение фазового перехода.
При какой температуре возможен переход вещества из газообразного состояния в жидкое? Какая температура называется критической?
Что такое критическое состояние вещества?
Чем газовое состояние отличается от жидкого с позиций молекулярно-кинетической теории?
Какое состояние вещества называют паром?
Опишите последовательно процесс сжижения пара при его изотермическом сжатии.
Дайте определение конденсации.
Дайте определение испарения.
Дайте определение идеального газа.
Запишите уравнения, применяемые для описания состояния идеального и реального газов.
Какой пар называется насыщенным? Почему при сжатии насыщенного пара его давление остается постоянным?
В чем заключается сущность метода определения критической температуры Каньяра де ля Тура?
Почему при сжатии жидкости давление резко возрастает?
Запишите формулу для расчета КПД цикла Карно.
Запишите уравнения Клапейрона-Клаузиуса.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная литература
Трофимова, Т.И. Курс физики (учебное пособие для технических специальностей ВУЗов) / Т.И. Трофимова. - М.: Издательский центр «Академия», 2007, 2008. - 560 с.
Дополнительная литература
Сивухин, Я.В. Общий курс физики. Т.1 / Я.В. Сивухин. - М.: Наука, главная редакция физико-математической литературы, 1979. - 519 с.
