
- •Часть I
- •Содержание
- •Лабораторная работа № 1
- •Аминокислоты
- •Реакции аминокислот, обусловленные одновременным присутствием карбоксильных и аминогрупп:
- •Реакции аминокислот, обусловленные присутствием карбоксильных групп:
- •Реакции аминокислот, связанные с присутствием аминогрупп:
- •Методы разделения и идентификации аминокислот
- •Пептиды
- •Реакция с формальдегидом
- •Реакция Адамкевича
- •Реакция Гопкинса-Коле
- •Лабораторная работа № 2
- •Физико-химические свойства белков
- •Лабораторная работа № 3
- •Сложные белки
- •Выделение казеина
- •Определение фосфорной кислоты в казеине
- •Гемопротеиды
- •Гемоглобин
- •Качественная реакция на гемовую группу. Бензидиновая проба
- •Методы количественного определения белка
- •Биуретовый метод Таблица 1
- •Метод Лоури Таблица 2
- •Метод Брэдфорд Таблица 3
- •Приложение Строение и номенклатура протеиногенных аминокислот
- •Классификация аминокислот по строению радикала.
- •Практикум по общей и экологической биохимии
- •Часть I
- •220009 Минск
Лабораторная работа № 2
Тема: |
Простые белки. Физико-химические свойства белков |
|
|
Цель работы: |
|
Оборудование и материалы:
Термостат
Пипетки стеклянные на 1 мл и 5 мл
Микропипетки автоматические
Цилиндры мерные на 250 мл и 100 мл
Колба емкостью 100 мл и 250 мл
Пробирки стеклянные
Штативы для пробирок
Бумага фильтровальная
Индикаторная бумага универсальная
Сито нейлоновое
Воронки стеклянные для фильтрации
Реактивы:
Яичный белок
Буферные растворы, рН 1.0, 3.7, 4.7, 5.7, 9.0
Гидроксид натрия (NaOH), 10% раствор
Хлорид натрия (NaCl), крист.
Хлорид натрия (NaCl), насыщенный раствор
Сульфат аммония ([NH4]2SO4), крист.
Сульфат аммония ([NH4]2SO4), насыщенный раствор
Сульфат магния (MgSO4), крист.
Сульфат меди (CuSO4), 2% раствор
Ацетат свинца (Pb(CH3COO)2), раствор
Желатин, порошок, 0.5% 1% раствор
Казеин, раствор
Уксусная кислота (CH3COOH), 1% раствор
Уксусная кислота (CH3COOH), 10% раствор
Азотная кислота (HNO3), конц., 5% раствор
Серная кислота (H2SO4), конц.
Соляная кислота (HCl), конц.
Трихлоруксусная кислота (ТХУ), 5% раствор
Спирт этиловый (C2H5OH), 96%
Ацетон
Фенол, насыщенный водный раствор
Формалин
Пикриновая кислота, насыщенный раствор
Таннин, 10% раствор
Гексацианоферрат калия (K3[Fe(CN)6]), 5% раствор
Вода дистиллированная
Теоретическая часть
Белки
Белки – высокомолекулярные органические вещества, состоящие из остатков -аминокислот, связанных между собой пептидными связями. Каждый белок характеризуется специфичной аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). Размер белка отражает его молекулярная масса, которая измеряется в дальтонах (Да) или, чаще, из-за относительно большой величины молекулы в производных единицах – килодальтонах (кДа).
Таблица 1. Молекулярная масса наиболее известных белков.
Белок |
Молекулярная масса (Да)
|
Инсулин |
5733 |
Цитохром С |
13000 |
Рибонуклеаза А |
13700 |
Миоглобин |
16890 |
Химотрипсин |
21600 |
Гемоглобин |
64500 |
Сывороточный альбумин |
68500 |
По составу белки делят на простые и сложные. К простым белкам относят макромолекулы, состоящие только из аминокислот. Сложные белки включают неаминокислотные компоненты, такие как гем, производные витаминов, липиды, углеводы, атомы металлов и другие.
Простые белки
Универсальной системы классификации белков не существует, хотя имеется несколько общеупотребимых систем классификации, частично перекрывающихся между собой. Здесь мы рассмотрим основные принципы классификации белков, основанные на их растворимости, форме молекул, функциях, физических свойствах и особенностях трехмерной структуры.
Растворимость
Простые белки по растворимости в воде и солевых растворах условно подразделяются на несколько групп: протамины, гистоны, альбумины, глобулины, проламины, глютелины (таблица 2).
Таблица 2. Растворимость наиболее известных типов белков.
Виды белков |
Растворимость и функция
|
Альбумины |
Белки с относительно небольшой молекулярной массой, хорошо растворимы в воде и в слабых солевых растворах. Осаждаются нейтральными солями при 100%-м насыщении. Участвуют в поддержании осмотического давления крови, транспортируют различные вещества. Альбуми-ны присутствуют в сыворотке крови, молоке, яичном белке. |
Глобулины |
Нерастворимы в воде, растворяются в водных растворах солей. Осаждаются в менее концентрированных солевых растворах (уже при 50%-м насыщении). Распространенные белки, входят в состав мышечных волокон, крови, молока, составляют большую часть семян бобовых и масличных культур. |
Протамины |
Проявляют выраженные оснóвные свойства. Хорошо растворимы в воде и слабых кислотах. Содержатся в половых клетках и составляют основную массу белка хроматина. Как и гистоны образуют комплекс с ДНК, Принимают участие в компактизации ДНК и придают ей химическую устойчивость. |
Гистоны |
Имеют сравнительно низкую молекулярную массу (12-13 кДа), с преобладанием щелочных свойств. Гистоны локализованы в клеточных ядрах. Растворимы в слабых кислотах, осаждаются аммиаком и спиртом. Не имеют олигомерной организации. В условиях in vivo прочно связаны с ДНК формируя нуклеопротеидные комплексы. Регулируют степень доступности ДНК для процессов репликации и транскрипции |
Проламины |
Растительные белки. Содержатся в клейковине злаковых растений. Растворимы только в 70%-м спирте (это объясняется высоким содержанием пролина и неполярных аминокислот). |
Строго установленных границ между отдельными классами простых белков не существует. Например, четкое разграничение между альбуминами и глобулинами невозможно, если исходить только из их растворимости в воде и солевых растворах. Поэтому глобулины дополнительно подразделяют на псевдоглобулины, легко растворимые в воде, и эуглобулины, нерастворимые в воде, в отсутствие солей.
Форма молекул
По форме молекул белки делят на глобулярные и фибриллярные (рис. 2.1). Глобулярные белки – это белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры – глобулы (третичные структуры белка). Глобулярная структура белков обусловлена гидрофобно-гидрофильными взаимодействиями. К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.
В фибриллярных белках вытянутые полипептидные цепи расположены параллельно друг другу, образуя протяженные нити или слои. Большинство фибриллярных белков не растворяются в воде. К фибриллярным белкам относят: -кератины – белки, входящие в состав волос, шерсти, перьев, рогов; коллаген – белок сухожилий и хрящей; фиброин – белок шёлка; актин, миозин и тубулин – внутриклеточные белки, участвующие в процессах мышечного сокращения и перемещения клеток.
Большинство фибриллярных белков обладают особым свойством – в формировании их пространственной структуры, кроме слабых взаимодействий, принимают участие и ковалентные связи непептидной природы, тогда как в глобулярных белках основной вклад в стабилизацию конформации молекулы вносят слабые нековалентные взаимодействия.
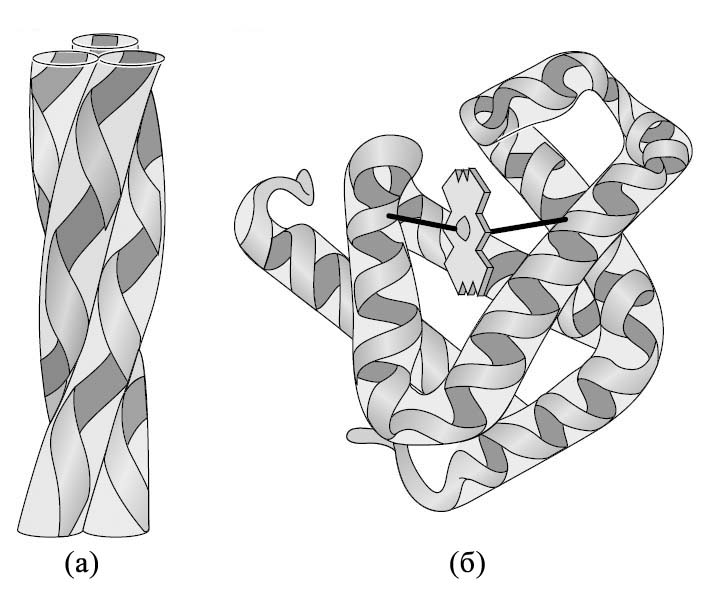
Рис. 2.1. (а) – Фибриллярный белок коллаген, (б) – Глобулярный белок миоглобин.
Функции
Белки также классифицируют в соответствии с их биологическими функциями. К наиболее важным биологическим функциям можно отнести следующие:
Каталитическая функция, осуществляется белками-ферментами (трансферазы, гидролазы, изомеразы, лиазы и др.). Ферменты играют важнейшую роль во всех процессах жизнедеятельности, обеспечивая протекание большинства реакций катаболизма и анаболизма клетки и всего организма в целом, а также направляя и регулируя обмен веществ.
Структурная функция. Структурные белки отвечают за поддержание формы и стабильности клеток и тканей. Основными структурными белками межклеточного вещества являются фибриллярные белки.
К структурным белкам относятся:
-кератин – в основном из кератина состоят мертвые клетки ороговевающего эпителия и их производные (волосы млекопитающих, рога, копыта, когти, перья птиц, чешуя рептилий и др.). В живых клетках эпителиальных тканей кератины образуют промежуточные филаменты;
эластин – широко распространённый в соединительной ткани белок, особенно в коже, легких и кровеносных сосудах. В эластине большое количество аминокислотных остатков с неполярными боковыми группами, а также содержится аминокислота десмозин, являющаяся производным лизина. Данные особенности строения обусловливает высокую эластичность его волокон;
коллаген – белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и др.) и обеспечивающий ее прочность и эластичность;
белки цитоскелета.
Транспортная функция. Транспортные белки участвуют в переносе метаболитов, ионов, О2 и других веществ в кровяном русле, во внеклеточных тканевых жидкостях, а также в трансмембранном переносе веществ в клетки (таблица 3)
Таблица 3. Характеристика ряда белков-переносчиков.
Белки-переносчики |
Переносимое вещество |
Альбумин |
Жирные кислоты, билирубин, альдостерон, глутатион |
Гемоглобин |
Кислород, углекислый газ |
Трансферрин |
Железо |
Церулоплазмин |
Медь |
Липопротеины |
Липиды |
Тироксинсвязывающий белок |
Тироксин |
Защитная функция. К защитным белкам относят, прежде всего, белки, участвующие в иммунной защите организма. К ним относятся иммуноглобулины, интерферон, лизоцим. К белкам, выполняющим функцию физической защиты организма можно отнести содержащиеся в плазме крови фибриноген (фибрин) и протромбин (тромбин) участвующие в процессах свертывания крови.
Двигательная функция присуща таким фибриллярным белкам как актин и миозин, участвующим в сокращении скелетных мышц Динеины и кинезины участвуют в энергозависимой транспортировке молекул и клеточных органелл вдоль микротрубочек. Динеины осуществляют перенос молекул и органоидов из периферических областей клетки по направлению к центросоме, кинезины действуют в противоположном направлении. Динеины также отвечают за движение ресничек и жгутиков эукариотических клеток.
Гормональная функция. Осуществляется такими белками, как инсулин, соматотропин (гормон роста), пролактин, тиреотропин, гонадотропин и другими.
Рецепторная функция. Указанная функция осуществляется белками-рецепторами, воспринимающими химические сигналы. Мембранные белки-рецепторы участвуют в трансдукции сигнала с поверхности клетки внутрь. Они регулируют функции клеток посредством изменения своей конформации в ответ на связывание сигнальной молекулы (лиганда), что приводит к активации ряда мембранных белков внутри клетки и синтезу так называемы вторичных посредников (месенджеров).
Регуляторная функция. Обеспечивается регуляторными белками, которые регулируют многие процессы внутри клеток (гистоны, белки-активаторы, белки-репрессоры и др.).
Резервная функция. В организме животных мышечные белки служат резервными питательными веществами, которые мобилизуются при крайней необходимости.
Конформация белков
Для описания пространственной организации белковых молекул используется такое понятие, как конформация. Полипептидные цепи индивидуальных белков за счет взаимодействия функциональных групп аминокислот приобретают определенную пространственную трехмерную структуру, называемую конформацией. Конформационная лабильность белков – это способность этих биополимеров к небольшим изменениям трехмерной структуры за счет разрыва одних и образования других слабых связей и взаимодействий в пределах одной молекулы.
Поскольку конформация белковой молекулы формируется при участии хотя и множества, но слабых взаимодействий различной природы, она обладает достаточной подвижностью так, что белок способен изменять ориентацию одной части молекулы относительно другой. В зависимости от условий внешней среды молекула может существовать в разных конформационных состояниях, которые легко переходят друг в друга. Энергетически выгодными для реальных условий являются только одно или несколько конформационных состояний, между которыми существует равновесие. Переходы из одного конформационного состояния в другое обеспечивают функционирование белковой молекулы. Эти обратимые конформационные переходы белков являются естественным физиологическим свойством данных биополимеров. Наиболее известной моделью, иллюстрирующей конформационные переходы в белках, является изменение состояния гемоглобина при его оксигенации/дезоксигенации.
Уровни структурной организации белковых молекул
Первичная структура белка
Под первичной структурой белков понимается длинная полипептидная цепь с характерной последовательностью аминокислот, соединённых между собой пептидной связью. Следовательно, первичная структура белка определяется тем, какие аминокислоты, сколько и в какой последовательности входят в состав полипептидной цепи. Пептидная связь образуется за счет взаимодействия -карбоксильной группы одной аминокислоты и -амино-группы другой аминокислоты.
В структурных формулах пептидов связь между карбонильным углеродом и атомом азота изображается как одинарная, однако на самом деле эта связь носит характер частично двойной связи. Действительно, классическая двойная связь между атомами С и О обеспечивала бы свободное вращение между атомами С и N в пептидной связи. При другой крайности: наличии двойной связи между атомами С и N вращение вокруг этой связи было бы невозможным, но в этом случае атомы О и N пептидной группы приобретали бы слишком большие заряды (атом N – положительный, а атом О – отрицательный). Истинная электронная плотность между атомами С, О и N в пептидной группе имеет промежуточное значение, что является достаточным условием, затрудняющим вращение связи С—N, но сохраняющим планарную структуру пептидной связи (рис. 2.2).
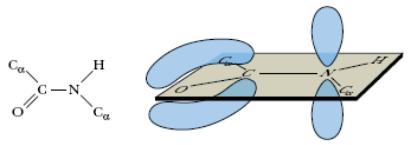
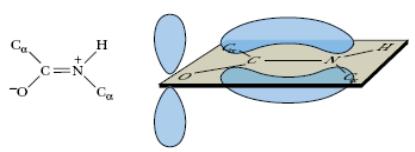
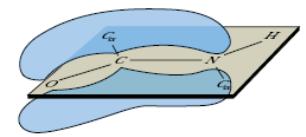
Рис. 2.2. Резонансная стабилизация пептидной связи придает ей характер частично двойной, чем объясняется заметная жесткость связи между атомами C и N.
Вращение вокруг остальных связей полипептидного остова, наоборот, является достаточно свободным и такая полужесткость структуры пептидной связи играет важную роль в формировании более высоких уровней структурной организации белковых молекул.
Вторичная структура
Этот уровень структурной организации описывает стерические взаимосвязи между расположенными близко друг к другу аминокислотами. Вторичная структура может быть регулярной (-спираль, складчатый -слой) или не обнаруживать признаков регулярности (неупорядоченная конформация). Тем не менее, во всех случаях в основе формирования вторичной структуры лежит образование многочисленных водородных связей между карбонильными кислородами одного остатка аминокислоты и водородом, принадлежащим атому азоту пептидного остова другой аминокислоты.
Упорядоченная вторичная структура
-Спираль
К основным параметрам характеризующим -спирализацию полипептидных цепей относятся следующие:
-Спираль стабилизируется водородными связями между атомами водорода NH-группы пептидной связи и карбонильным кислородом аминокислотного остатка, отстоящего от данной пептидной группы на четыре позиции вдоль цепи (рис. 2.3).
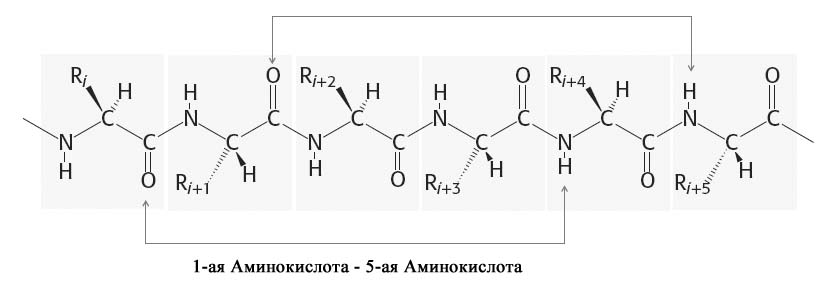
Рис. 2.3. Принцип образования водородных связей в -спирали.
На один виток -спирали приходится 3,6 аминокислотных остатка и шаг спирали составляет 0,54 нм.
В образовании водородных связей участвуют все атомы водорода NH-групп и атомы карбонильного кислорода пептидных связей, что обеспечивает максимальную стабильность -спирали и в значительной степени снижает гидрофильность -спирализованных участков.
-Спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии.
Правосторонняя -спираль (рис. 2.4), обычно обнаруживаемая в белках, отличается намного большей стабильностью, чем левосторонняя.
Стабильность -спирали в значительной степени зависит от аминокислотного состава соответствующего участка полипептидной цепи (таблица 4).
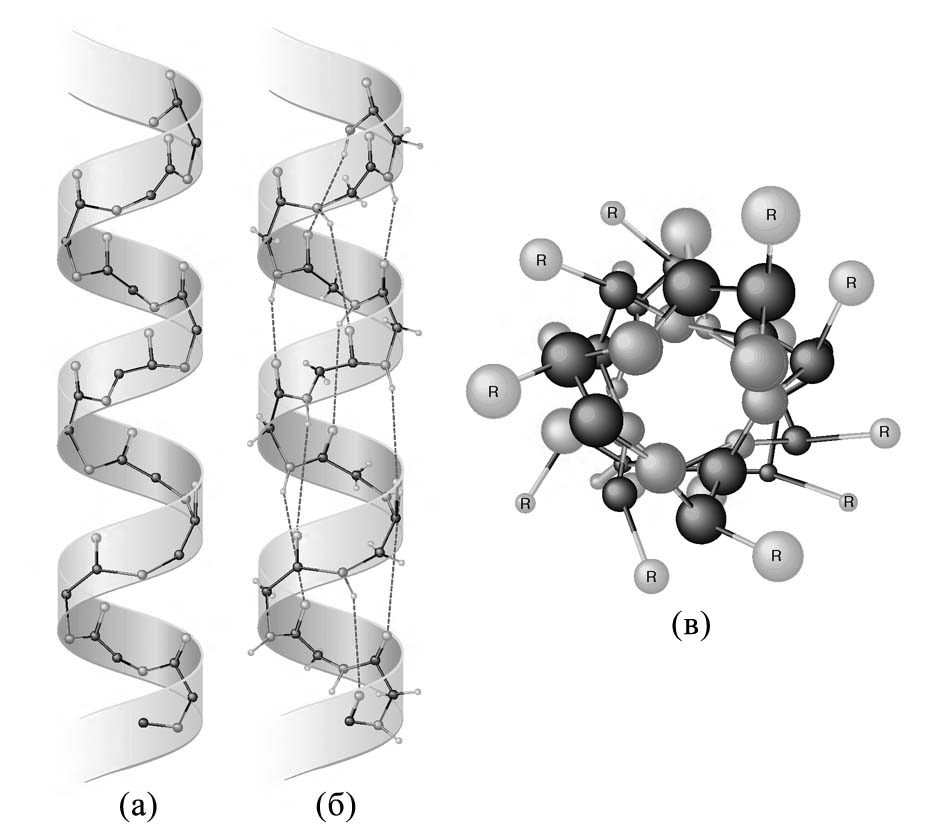
Рис. 2.4. Архитектура -спирали. Вид сбоку (а, б) и вид сверху (в).
Таблица 4. Влияние различных аминокислот на формирование -спирали.
Стабилизируют
|
Дестабилизируют |
Препятствуют |
Ala |
Arg |
Pro |
Asn |
Asp |
Hyp |
Cys |
Glu |
|
Gln |
Gly |
|
His |
Lys |
|
Leu |
Ile |
|
Met |
Ser |
|
Phe |
Thr |
|
Trp |
|
|
Tyr |
|
|
Val |
|
|
В некоторых белках степень -спирализованности может достигать практически 100%, другие белки вовсе лишены -спиралей. К факторам, которые препятствуют образованию -спиралей относят расположение подряд нескольких одноименно заряженных аминокислотных остатков (электростатическое взаимное отталкивание), или аминокислот с объемными боковыми R-группами (пространственное несоответствие). Некоторые аминокислоты в силу структурных особенной своих боковых радикалов не способны принимать участие в формировании -спирали, благодаря чему в месте их расположения непрерывность -спирали нарушается. К таким аминокислотам относится пролин (атом азота пролина является частью жесткой кольцевой структуры, и вращение вокруг связи С—N в кольце становится невозможным).
Складчатый -слой
Альтернативная упорядоченная вторичная структура белка – складчатый -слой – была предложена Полингом и Кори. В то время как в -спирали полипептидная цепь находится в конденсированном состоянии, в складчатом -слое цепи почти полностью вытянуты (рис. 5). В тех случаях, когда соседние полипептидные цепи складчатого -слоя идут в противоположных направлениях (за положительное принимается направление от N- к С-концу), структуру называют антипараллельной. Когда соседние цепи идут в одном направлении, структуру -слоя называют параллельной (рис. 2.5).
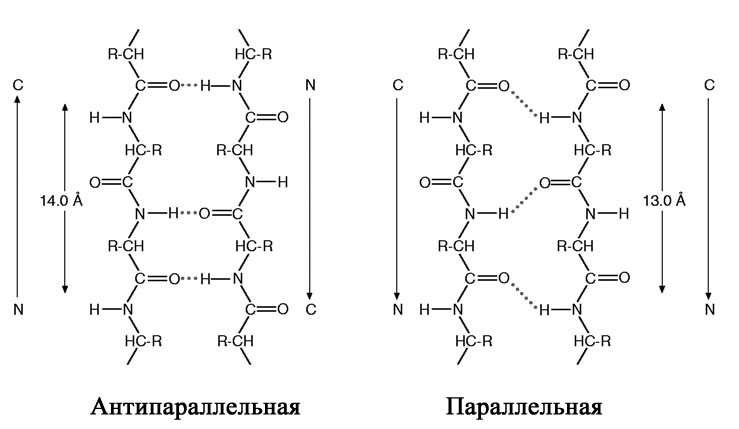
Рис. 2.5. Принципы организации антипараллельного и параллельного складчатого -слоя.
Области складчатой -структуры присутствуют во многих белках, причем встречается как параллельная, так и антипараллельная формы. В формировании таких структур могут участвовать от двух до пяти соседних полипептидных цепей. Во многих белках одновременно присутствуют и -спирали, и складчатая -структура.
Неупорядоченная вторичная структура (конформация клубка)
Те участки белковой молекулы, которые не относятся ни к спирализованным, ни к складчатым структурам, обычно называют неупорядоченными. В конформации клубка может находиться значительная часть белковой молекулы. Нужно отметить, что с точки зрения биологической значимости неупорядоченные участки белка столь же важны, как -спираль и -структура.
Третичная структура
Третичной структурой белковых молекул называется трехмерная пространственная организация белка, формирующаяся и стабилизирующаяся за счет многих и различных по природе слабых взаимодействий между остатками аминокислот, которые могут располагаться на значительном расстоянии друг от друга в составе полипептидной цепи. К таким взаимодействиям относятся солевые мостики, водородные связи, гидрофобные взаимодействия, а также ковалентные дисульфидные связи (рис. 2.6).
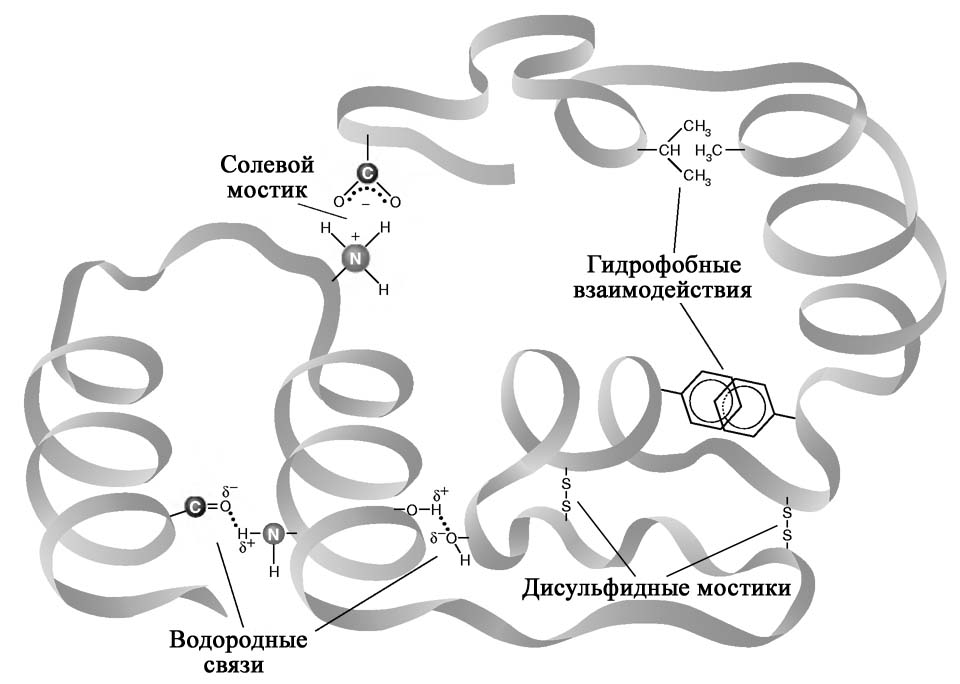
Рис. 2.6. Связи и взаимодействия в третичной структуре белка.
Гидрофобные взаимодействия. Неполярные молекулы или части молекул не способные взаимодействовать с водой называются гидрофобными. К гидрофобным группам относятся алкильные и арильные (ароматические) радикалы ряда аминокислот. Гидрофобные радикалы аминокислотных остатков избегают контактов с водным окружением и стремятся собраться вместе внутри глобулярной структуры, где они формируют гидрофобное ядро.
Электростатические взаимодействия. К ним относятся ион-ионные, ион-дипольные и диполь-дипольные взаимодействия. Эти ионные связи возникают между разноименно заряженными группами боковых цепей аминокислот. Например, при физиологических значениях рН -аминогруппа лизина несет заряд +1, а карбоксильная группа глутаминовой кислоты в составе боковой цепи несет заряд 1. Следовательно, боковые радикалы указанных аминокислот способны взаимодействовать друг с другом электростатически, дополнительно стабилизируя структуру белка, за счет образования солевых мостиков.
Дисульфидные мостики. Третичная структура ряда белков может стабилизироваться дисульфидными мостиками (—S— S—), образующимися за счет ковалентного взаимодействия SH-групп двух остатков цистеина (рис. 2.7). Принимающие участие в образовании (—S—S—)-мостиков остатки цистеинов могут быть линейно существенно разобщены в полипептидной цепи, однако при формировании третичной структуры SH-группы таких остатков цистеина оказываются пространственно сближенными и ковалентно сшивают два участка одной полипептидной цепи (или соседних цепей).
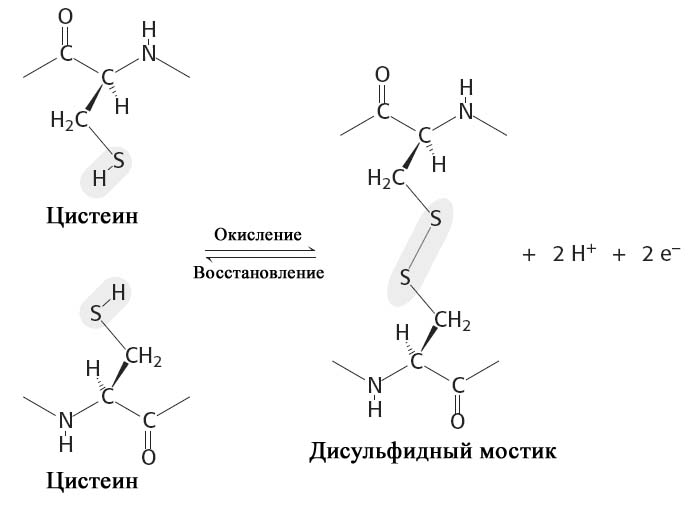
Рис. 2.7. Связи и взаимодействия в третичной структуре белка.
Водородные связи. В отличие от водородных связей поддерживающих вторичные структуры белков, водородные связи, участвующие в стабилизации третичной структуры более разнообразны (рис. 2.8). В этом случае водородные связи образуются:
между боковыми R-группами аминокислот;
между карбонильными атомами кислорода и атомами амидного водорода, принадлежащими пептидным группам остова;
между поверхностными остатками полярных аминокислот белка и молекулами воды, расположенными в соседних петлях полипептидной цепи;
между, например, гидроксильной группой остатка серина в одном участке полипептидной цепи и атомом азота в кольце остатка гистидина, находящегося в соседней петле той же цепи;
между амидной группой глутамина в одном участке полипептидной цепи и остатком тирозина в другом участке.
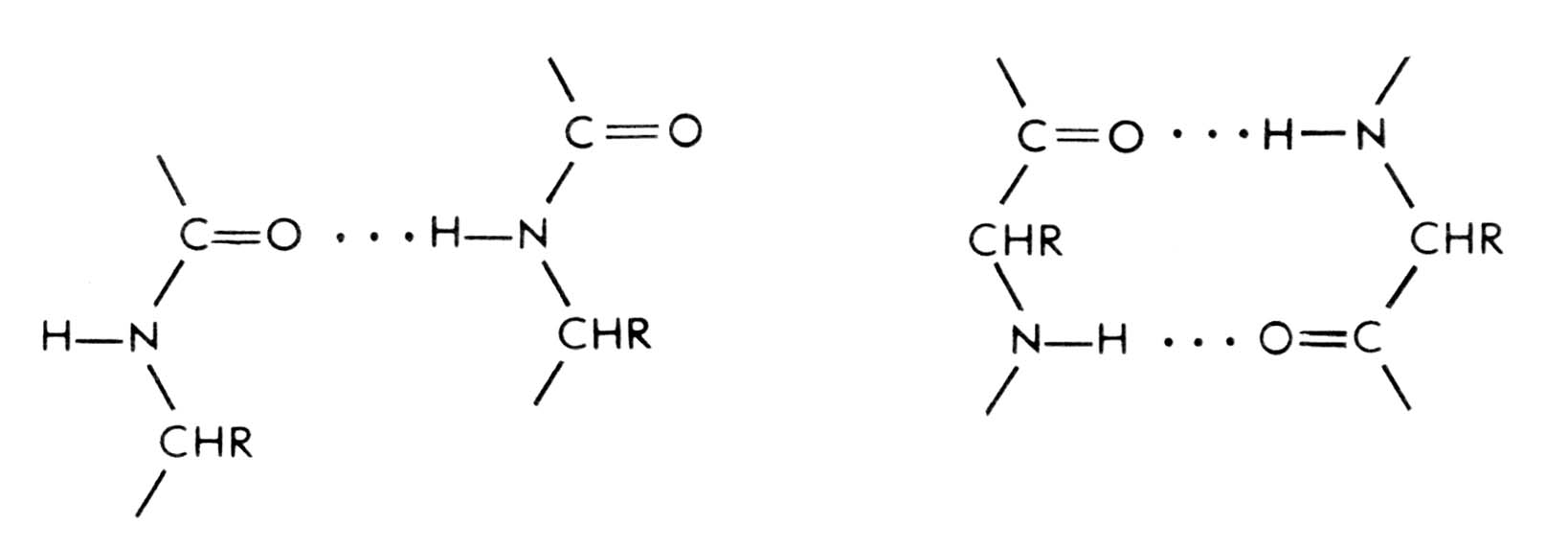
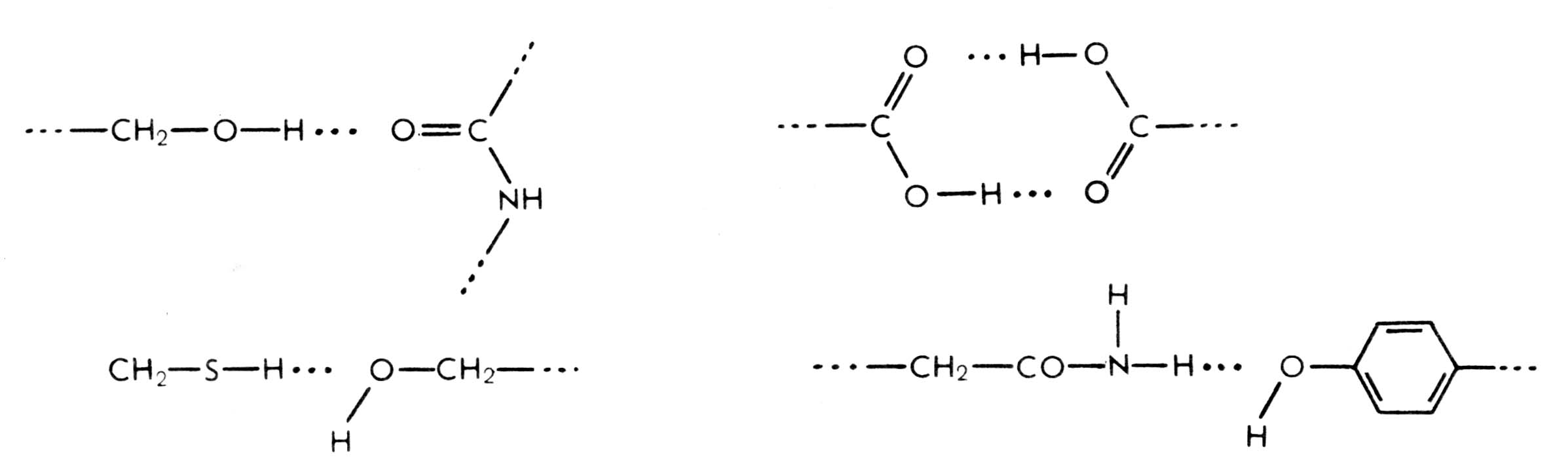
Рис. 2.8. Различные варианты формирования водородных связей в третичной структуре белка.
Четвертичная структура
Четвертичной (олигомерной) структурой обладают белки, построенные из двух и более полипептидных цепей, каждая из которых уложена в соответствующую третичную структуру. Олигомерная организация белка стабилизируется водородными связями, электростатическими и гидрофобными взаимодействиями между аминокислотными остатками, находящимися на поверхности индивидуальных полипептидных цепей. Полипептидные цепи, соответствующие каждому из олигомеров белка получили название мономеров или субъединиц. Субъединицы, формирующие четвертичную структуру олигомерного белка, могут быть одинаковыми или разными, другими словами они могут иметь одинаковую молекулярную массу и обладать одинаковой третичной организацией, а могут отличаться друг от друга по указанным параметрам. В тоже время под протомером понимают наименьшую повторяющуюся часть олигомера. Многие олигомерные белки состоят из двух или четырех субъединиц и называются, соответственно, димерами или тетрамерами. Однако довольно часто встречаются олигомеры, содержащие более четырех субъединиц. Это особенно характерно для регуляторных белков.

Рис. 2.9. Принцип формирования гомоолигомеров.
Олигомерные белки играют особую роль во внутриклеточной регуляции: их протомеры способны циклически (т.е. обратимо) изменять взаимную ориентацию, что приводит к изменению свойств всего олигомера. Наиболее изученным примером олигомерного белка является гемоглобин.
Роль первичной структуры в формировании более высоких уровней структурной организации белков трудно переоценить. Действительно, вторичная и третичная структуры белков, формирующиеся самопроизвольно, определяются последовательностью аминокислот в полипептидных цепях. Эти процессы детерминируются химическими группами, соединенными с -углеродными атомами аминокислотных остатков. Таким образом, можно сказать, что не существует независимого генетического контроля по формированию уровней структурной организации белков выше первичного, поскольку первичная структура специфически определяет и вторичную, и третичную, и четвертичную структуры. Нативной конформацией белка, по-видимому, следует считать термодинамически наиболее устойчивую структуру в конкретных условиях.
Макромолекулярные белковые комплексы
Полифункциональные макромолекулярные комплексы образуются в результате ассоциации функционально разных белков, каждый из которых обладает всеми четырьмя уровнями структурной организации. Такое компактное расположение белков позволяет им более эффективно выполнять свои функции. Макромолекулярные комплексы функционируют в системе транспорта электронов, участвуют в биосинтезе жирных кислот, метаболизме пирувата и других синтетических и катаболических путях.
