
- •Часть I
- •Содержание
- •Лабораторная работа № 1
- •Аминокислоты
- •Реакции аминокислот, обусловленные одновременным присутствием карбоксильных и аминогрупп:
- •Реакции аминокислот, обусловленные присутствием карбоксильных групп:
- •Реакции аминокислот, связанные с присутствием аминогрупп:
- •Методы разделения и идентификации аминокислот
- •Пептиды
- •Реакция с формальдегидом
- •Реакция Адамкевича
- •Реакция Гопкинса-Коле
- •Лабораторная работа № 2
- •Физико-химические свойства белков
- •Лабораторная работа № 3
- •Сложные белки
- •Выделение казеина
- •Определение фосфорной кислоты в казеине
- •Гемопротеиды
- •Гемоглобин
- •Качественная реакция на гемовую группу. Бензидиновая проба
- •Методы количественного определения белка
- •Биуретовый метод Таблица 1
- •Метод Лоури Таблица 2
- •Метод Брэдфорд Таблица 3
- •Приложение Строение и номенклатура протеиногенных аминокислот
- •Классификация аминокислот по строению радикала.
- •Практикум по общей и экологической биохимии
- •Часть I
- •220009 Минск
Пептиды
Пептиды – это природные или синтетические соединения, молекулы которых построены из остатков α-аминокислот, соединённых между собой пептидными связями. В зависимости от количества остатков аминокислот и молекулярной массы различают: низкомолекулярные пептиды (состоящие из двух – десяти остатков аминокислот – ди-, три-, тетра-, пентапептиды и так далее), пептиды со средней молекулярной массой (от 500 до 5000 дальтон, так называемые «средние молекулы») и высокомолекулярные пептиды (с молекулярной массой от 5000 до 16000 дальтон). Наиболее распространены линейные пептиды, однако известны также циклические пептиды, молекулы которых могут иметь различные размеры. В природе встречаются пептиды, построенные не только из аминокислот, но содержащие также оксикислоты, длинные остатки жирных кислот и другие компоненты. Поэтому различают гомомерные пептиды, состоящие исключительно из аминокислот и гетеромерные пептиды, которые кроме аминокислот содержат также небелковые компоненты.
Пептиды широко распространены в природе. Они присутствуют во всех клеточных организмах (пептидный пул). Открытые и изученные в настоящее время пептиды можно разделить на группы по их основному физиологическому действию:
пептиды, обладающие гормональной активностью (окситоцин, вазопрессин, рилизинг-гормоны гипоталамуса, меланоцитстимулирующий гормон, глюкагон, инсулин, и др.);
пептиды, регулирующие процессы пищеварения (гастрин, холецистокинин, вазоинтестинальный пептид, желудочный ингибирующий пептид и др.);
пептиды, регулирующие тонус сосудов и артериальное давление (брадикинин, калидин, ангиотензин II);
пептиды, регулирующие аппетит (лептин, нейропептид Y, меланоцитстимулирующий гормон, β-эндорфины);
пептиды, обладающие обезболивающим действием (энкефалины и другие опиоидные пептиды);
пептиды, являющиеся токсичными веществами (аманитин, антибиотики, вырабатываемые некоторыми микроорганизмами);
пептиды, участвующие в регуляции высшей нервной деятельности, в биохимических процессах, связанных с механизмами сна, обучения, памяти, возникновения чувства страха и так далее.
Однако такое деление пептидов крайне условно, так как многие из них обладают широким спектром действия.
Качественные реакции на пептиды и белки
Биуретовая реакция позволяет обнаруживать в молекулах пептидов и белков пептидные связи. В щелочной среде белки, а также продукты их гидролиза – полипептиды – дают фиолетовое окрашивание с солями меди. Положительная биуретовая реакция проявляется у соединений, содержащих не менее двух пептидных групп (то есть у трипептидов, тетрапептидов и т.д.). Интенсивность окраски зависит от длины пептида и варьирует от сине-фиолетовой до красно-фиолетовой и красной.
Изучение механизма данной реакции показало, что с солями меди сходным образом взаимодействует биурет, который легко получается при нагревании мочевины:
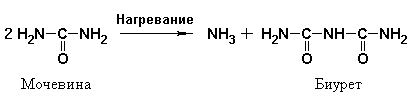
В любом случае появление окраски связано с образованием комплексного соединения – биуретового медного комплекса, который имеет следующее строение:
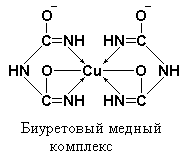
Как можно видеть из приведенной выше формулы, биурет в щелочной среде претерпевает полную енолизацию по схеме:

Две молекулы диенольной формы биурета взаимодействуют с гидроксидом меди (II) и образуют комплексное соединение, в котором координационные связи образованы за счет электронных пар атомов азота иминных групп. Аналогично организовано комплексное соединение меди с енолизированными пептидными группами любого другого полипептида:
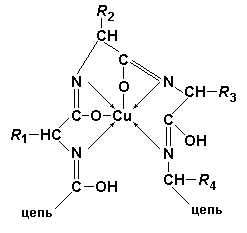
Контрольные вопросы
Принцип строения аминокислот
Классификация аминокислот
Стереоизомерия аминокислот
Ионные формы аминокислот. Влияние рН на заряд аминокислоты
Кривые титрования аминокислот.
Химические свойства аминокислот
Пептидная связь. Химический и биологический способы образования пептидных связей
Методы качественного определения аминокислот
Методы количественного определения аминокислот
Литература
Кольман Я., Рем К.-Г., Наглядная биохимия, «Мир», М., 2000.
Ленинджер А., Основы биохимии, т.1, «Мир», М., 1985.
Марри Р., Греннер Д., Мейес П., Родуэлл В., Биохимия человека, т. 1, «Мир», М., 1993.
Северин Е.С., Биохимия, «Гэотар-мед», М., 2004.
Степанов В.М., Молекулярная биология: структура и функции белков, под ред. Академика Спирина А.С., «Высшая школа», М., 1996.
Кнорре Д.Г., Мызина С.Д., Биологическая химия, «Высшая школа», М., 1998.
Горячковский А.М., Справочное пособие по клинической биохимии, «ОКФА», Одесса, 1994.
Чиркин А.А., Практикум по биохимии, «Новое знание», Минск, 2002.
Кухта В.К., Морозкина Т.С., Олецкий Э.И., Таганович А.Д., Биологическая химия, «Бином», М., 2008.
Дополнительная литература
Nelson D.L., Cox M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004.
Metzler D., Biochemistry, (The chemical reactions in living cells), Elsevier, Academic Press, V. 1-2, 2003-2004.
Berg J.M., Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006.
Ход работы
Цель работы: |
Обнаружение и идентификация аминокислот в водных растворах. Проведение качественных реакций на аминокислоты, пептиды и белки |
|
|
Задание I |
Изучить химические и хроматографические свойства аминокислот. |
Реакции аминокислот в водных растворах
На универсальную индикаторную бумагу пипеткой наносят по 1 капле растворов глицина, глутаминовой или аспарагиновой кислоты и аргинина.
Отмечают развивающуюся окраску индикатора во всех трех случаях и делают заключение о реакции среды.
Записывают уравнения реакций, описывающих поведение данных аминокислот в водных растворах.
Взаимодействие аминокислот с сахарами
В две пробирки вносят по 2 мл 5% раствора фруктозы в 2.5% растворе борной кислоты.
В первую пробирку добавляют 2 мл 3% раствора аргинина, а во вторую – 2 мл дистил-лированной воды.
В третью пробирку вносят 2 мл 3% раствора аргинина и 2 мл 2.5% раствора борной кислоты.
Все три пробирки инкубируют в течение 5 мин в кипящей водяной бане.
Отмечают различие во времени появления окраски и ее интенсивности в каждой из проб.
Разделение смеси аминокислот методом хроматографии на бумаге.
На полосе хроматографической бумаги отмечают линию старта (1-1.5 см от края бумаги), а также места нанесения стандартных растворов аминокислот и анализируемой смеси.
Микропипеткой наносят на хроматографическую бумагу по 20 мкл раствора каждой аминокислоты. Нанесение проводят в несколько приемов, следя за тем, чтобы пятно раствора не растекалось более чем на 3 мм. Каждую последующую порцию раствора наносят после полного высыхания предыдущей, что определяют по исчезновению просвечивания бумаги в точке нанесения.
Точки старта высушивают.
Параллельно готовят 20 мл растворителя, состоящего из н-бутанола, уксусной кислоты и воды в соотношении 12:3:5. К растворителю добавляют несколько кристаллов нингидрина для окрашивания хроматограммы во время проявления.
Растворитель заливают в хроматографическую камеру, герметично закрывают и оставляют на некоторое время для насыщения парами.
Бумажную полоску помещают в хроматографическую камеру. Проявление заканчивают когда фронт растворителя переместится к противоположному концу полоски (2-3 см от края).
Хроматограмму высушивают.
Определяют значения Rf аминокислот. Идентифицируют аминокислоты, содержащиеся в анализируемой смеси.
Задание II |
Изучение методов идентификации индивидуальных аминокислот в растворах по качественным реакциям
|
Приготовление 1% раствора белка для проведения качественных реакций
Отделяют белок куриного яйца от желтка, считая, что масса белка в одном яйце в среднем составляет 30г, а его концентрация 10%.
Белок помещают в мерный цилиндр и добавляют девятикратный объем дистиллированной воды.
Полученный раствор тщательно перемешивают и фильтруют через нейлоновое сито.
Нингидриновая реакция
В четыре пробирки наливают 2 мл 1% раствора белка, 2 мл 0.01% раствора глицина, 2 мл 0.01% раствора -аланина и 2 мл воды, соответственно.
Во все пробирки добавляют по 10 капель 0,1% раствора нингидрина.
Растворы перемешивают и оставляют в водяной бане при 70˚С на 5 минут.
Отмечают появление окраски в некоторых пробирках.
Ксантопреновая реакция
В четыре пробирки наливают 1 мл 1% раствора белка, 1 мл 0.01% раствора триптофана, 1 мл 1% раствора желатина и 1 мл воды соответственно.
Во все пробирки добавляют по 5-6 капель концентрированной азотной кислоты и осторожно нагревают.
После охлаждения в пробирки осторожно (по стенке) приливают избыток 10% раствора NaOH.
Отмечают появление окраски в некоторых пробирках.
Реакция Фоля
В три пробирки наливают 2 мл 1% раствора белка, 2 мл 0.02% раствора цистеина и 2 мл 1% раствора желатина, соответственно.
Во все пробирки добавляют по 1 мл 10% раствора NaOH.
Пробирки осторожно нагревают до кипения, кипятят в течение 2 мин.
Далее в каждую пробирку добавляют по 3 капли раствора Pb(CH3COO)2.
Отмечают появление окраски в некоторых пробирках.
Качественные реакции на триптофан
