
- •Часть I
- •Содержание
- •Лабораторная работа № 1
- •Аминокислоты
- •Реакции аминокислот, обусловленные одновременным присутствием карбоксильных и аминогрупп:
- •Реакции аминокислот, обусловленные присутствием карбоксильных групп:
- •Реакции аминокислот, связанные с присутствием аминогрупп:
- •Методы разделения и идентификации аминокислот
- •Пептиды
- •Реакция с формальдегидом
- •Реакция Адамкевича
- •Реакция Гопкинса-Коле
- •Лабораторная работа № 2
- •Физико-химические свойства белков
- •Лабораторная работа № 3
- •Сложные белки
- •Выделение казеина
- •Определение фосфорной кислоты в казеине
- •Гемопротеиды
- •Гемоглобин
- •Качественная реакция на гемовую группу. Бензидиновая проба
- •Методы количественного определения белка
- •Биуретовый метод Таблица 1
- •Метод Лоури Таблица 2
- •Метод Брэдфорд Таблица 3
- •Приложение Строение и номенклатура протеиногенных аминокислот
- •Классификация аминокислот по строению радикала.
- •Практикум по общей и экологической биохимии
- •Часть I
- •220009 Минск
Аминокислоты
Аминокислоты как основные составные части белков участвуют во всех жизненных процессах наряду с нуклеиновыми кислотами, углеводами и липидами. Кроме аминокислот, входящих в состав белков, живые организмы обладают постоянным резервом «свободных» аминокислот, содержащихся в тканях и в клеточном соке. Данные молекулы используются в синтезе множества биологически активных соединений, к которым относятся нейромедиаторы и гормоны, обеспечивающие регуляцию процессов обмена веществ в организме. Аминокислоты служат донорами атомов азота при синтезе всех небелковых азотсодержащих соединений, в том числе нуклеотидов, гема, креатина, холина и других веществ. Аминокислоты и их производные входят в состав коферментов, желчных кислот, антибиотиков.
Различают протеиногенные и непротеиногенные аминокислоты.
Аминокислоты, которые в соответствии с генетическим кодом включаются в состав белков в процессе трансляции, называются протеиногенными. В состав белков входят 20* протеиногенных аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется содержанием и последовательностью расположения входящих в них аминокислот. Последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка.
Аминокислоты, которые нередко обнаруживаются в белках, но не имеют кодовых слов и не включаются в белки в процессе трансляции, называются непротеиногенными. Обнаружение таких аминокислот в белках объясняется протеканием реакций модифицирования данных биомолекул пост-трансляционно или, например, рацемизацией аминокислот в составе белков (см. далее). Непротеиногенные аминокислоты могут образовываться в качестве промежуточных продуктов при биосинтезе и деградации протеиногенных аминокислот, а также других органических молекул.
Строение аминокислот. Аминокислоты – это аминопроизводные класса карбоновых кислот. Основными функциональными группами аминокислот являются их амино- и карбоксильные группы, которые связаны с одним и тем же атомом () углеродного скелета аминокислоты (рис. 1.1). Между собой аминокислоты различаются только строением боковых цепей (R–группами), которые у разных аминокислот неодинаковы по структуре, электрическому заряду и растворимости в воде.
*В 2002 г. была открыта 21-ая протеиногенная аминокислота – селеноцистеин.
При физиологических значениях рН аминокислоты в растворах находятся преимущественно в виде биполярных ионов (обычно используемая запись строения -аминокислоты в неионизированном виде служит лишь для удобства).

Рис. 1.1. Общая структурная формула -аминокислот.
Стереоизомерия аминокислот. Это свойство связано с наличием в молекуле всех природных аминокислот (за исключением глицина) в -положении асимметрического атома углерода (хирального центра), все четыре валентные связи которого заняты различными заместителями. Аминокислоты cущeствуют в виде двух зеркальных изомеров (рис. 1.2) или энантиомеров: L- и D-aминoкиcлoт.
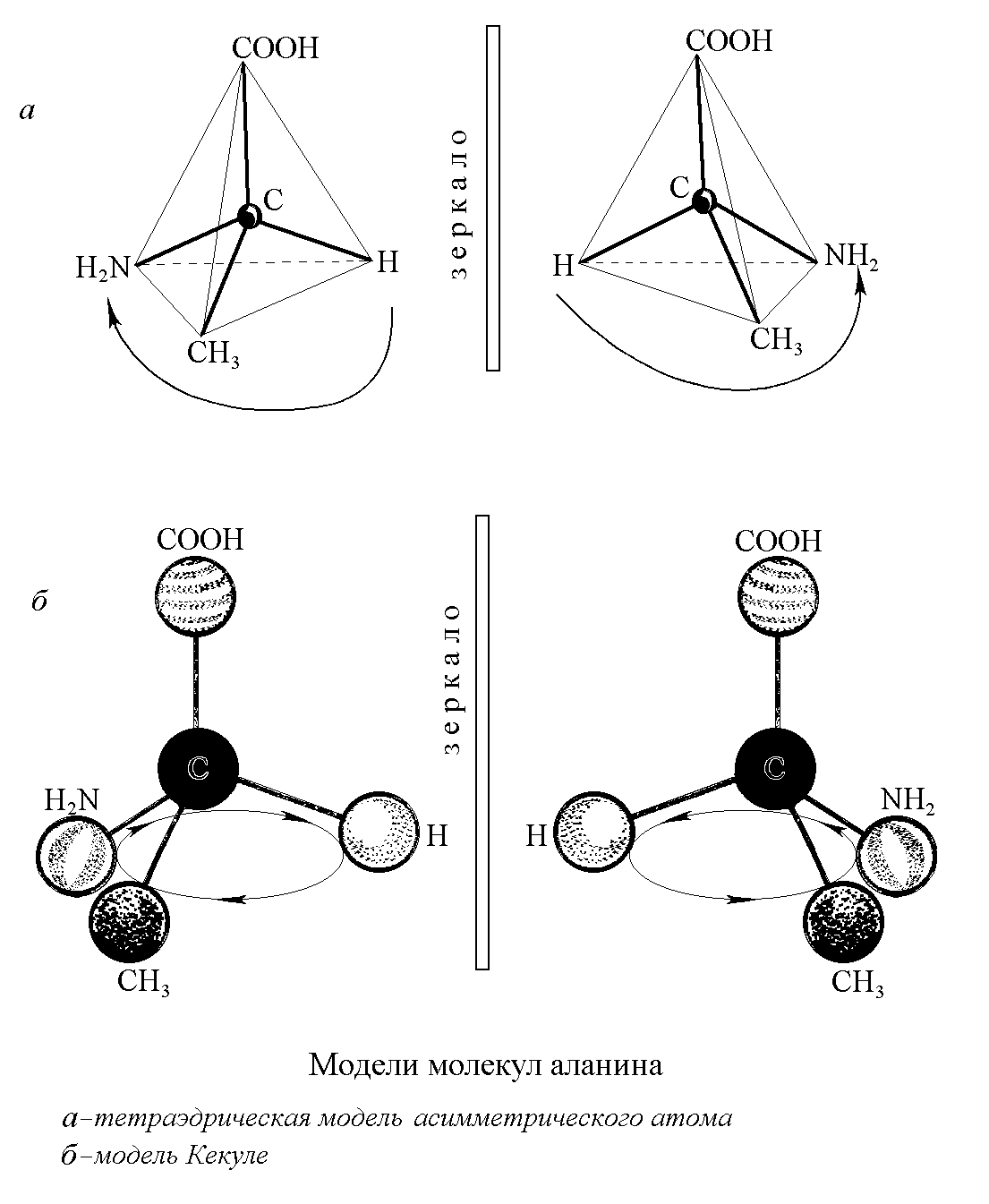
Рис. 1.2. Модели асимметрических молекул аланина. а – тетраэдрическая модель, б – модель Кекуле.
Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода (рис. 1.3). Два возможных его стереоизомера принято обозначать буквами L и D.
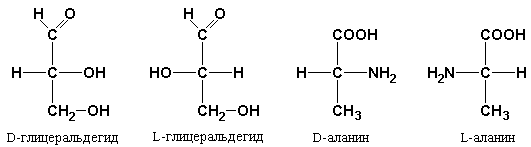
Рис. 1.3. Стерическое соответствие между структурой энантиомеров аланина и абсолютной конфигурацией L- и D-глицеральдегида.
Стереоизомеры всех хиральных соединений, соответствующие по конфигурации L-глицеральдегиду, обозначаются буквой L, а стереоизомеры, соответствующие D-глицеральдегиду – буквой D.
Все пpотeиногенныe аминoкиcлoты oтноcятcя к L-ряду. D-Аминoкиcлоты вcтpeчaютcя во многих природных пептидах, продуцируемых микроорганизмами, например в антибиотиках (грамицидин, актиномицин, полимиксин), а также в составе биополимеров клеточной стенки бактерий.
Среди протеиногенных аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два асимметрических атома углерода. Для них возможно существование четырёх стереоизомеров. Например, у треонина, помимо L- и D-треонина, имеется ещё два стереоизомера, которые называются диастереоизомерами или аллоформами: L-аллотреонин и D-аллотреонин (рис. 1.4).
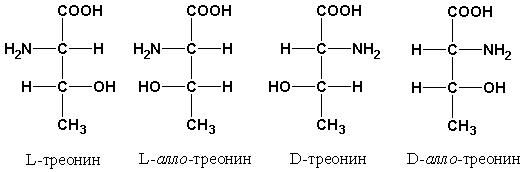
Рис. 1.4. Структурные конфигурации стереоизомеров треонина.
Чистые L- или D-стереоизомеры могут со временем самопроизвольно и неферментативно превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,10 % в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст обследуемого.
Физические свойства. Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они хорошо растворяются в воде, аммиаке и других полярных растворителях, в неполярных и слабополярных растворителях (этанол, метанол, ацетон) растворяются плохо. Причиной такого поведения является легкий переход незаряженной молекулы в цвиттерион, который связан с выигрышем свободной энергии.
Кислотно-основные свойства. Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), то есть каждая аминокислота содержит как минимум одну кислотную (–СООН) и одну основную (–NH2) группы. В растворе эти группы находятся в двух формах, заряженной и незаряженной, между которыми поддерживается протонное равновесие:
R–COOH и R–NH3+ являются протонированными партнерами, то есть кислотами (донорами протонов), а R–COO¯ и R–NH2 – сопряженными основаниями (акцепторами протонов).
Поэтому в водной среде -аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы (рис. 1.5):
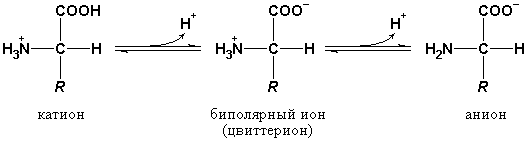
Рис. 1.5. Ионные формы аминокислот.
Соотношение между этими формами, то есть заряд молекул аминокислот в растворе зависит от рН среды (рис. 1.6).
Изменение рН в кислую среду приводит к подавлению диссоциации кислотных групп. Поэтому в сильнокислой среде аминокислоты существуют преимущественно в виде катионов (приобретают положительный заряд).
Напротив, изменение рН в щелочную среду, вызывает отщепление протонов от основных функциональных групп. Поэтому в сильнощелочной среде аминокислоты существуют преимущественно в виде анионов.
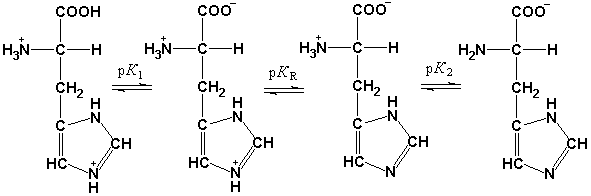
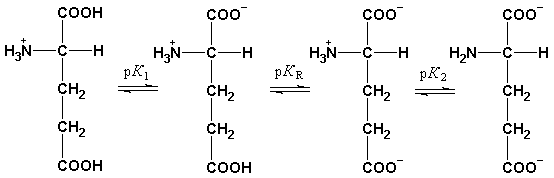
Рис. 1.6. Изменение суммарного заряда аминокислот (гистидина и глутамата) в зависимости от рН среды.
При нейтральных значениях рН все кислотные и все основные функциональные группы аминокислот находятся в диссоциированном состоянии. Поэтому нейтральные аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд и существуют в виде биполярного иона (цвиттериона). Кислые аминокислоты содержат две карбоксильные группы, которые диссоциируют, отдавая два протона, но поскольку у них только одна аминогруппа, принимающая один протон, то такие аминокислоты ведут себя как кислоты и раствор их имеет кислую реакцию. Сам ион аминокислоты заряжается отрицательно. Основные аминокислоты реагируют в водном растворе как слабые основания, так как один протон, который освобождается при диссоциации карбоксильной группы, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, в результате увеличивается количество OH– групп и повышается pH среды. Заряд иона таких аминокислот в нейтральной среде будет положительным.
При определенном значении pH наступает такое состояние, при котором заряд аминокислоты становится нейтральным (скомпенсированным). Значение рН, при котором суммарный заряд аминокислоты равен нулю и она не перемещается в постоянном электрическом поле, называется ее изоэлектрической точкой (рI).
Таким образом, при значении pH = рI, аминокислоты не перемещаются в электрическом поле и обладают наименьшей растворимостью. Если pH < рI, катион аминокислоты движется к катоду, а при pH > рI, анион аминокислоты – к аноду. На этих свойствах аминокислот основана возможность разделения их в электрическом поле (электрофорез). Изоэлектрическая точка кислых аминокислот находится в слабокислой среде, основных – в слабоосновной, а нейтральных – в нейтральной среде. Изоэлектрическая точка для нейтральных аминокислот рассчитывается по формуле:
рI = ½ (рК1 + рК2), где
рК1 – величина рК для -карбоксильной группы, а рК2 — для -аминогруппы.
Изоэлектрическая точка для кислых и основных аминокислот рассчитывается по формуле:
рI = ½ (рК1 + рКR), где
рКR – рК для ионизированной группы, находящейся в радикале.
Кривые титрования аминокислот. Если регистрировать изменение рН раствора аминокислот при добавлении щелочи или кислоты, то получаются типичные кривые титрования аминокислот, зависящие от числа ионизированных групп (рис. 1.7-1.9).
Если радикалы аминокислот нейтральны, то они почти не оказывают влияния на диссоциацию -карбоксильной группы или -аминогруппы, и величины рК (то есть значения рН, при которых эти группы в среднем наполовину диссоциированы) остаются относительно постоянными. Вследствие этого кривые титрования почти всех нейтральных аминокислот накладываются друг на друга и могут быть рассмотрены на примере аланина (рис. 1.7).
В начале титрования (при значении pH < рК1) большинство молекул аланина находятся в полностью протонированной форме и в растворе преобладают ионы +NH3–CHR–COOH. При приближении значения рН к 2,34 (численно равном величине рК1 -карбоксильной группы) начинает происходить активная диссоциация протонов от -карбоксильных групп, что при рН 2,34 приводит к присутствию в растворе в эквимолярных концентрациях ионов +NH3–CHR–COOH и +NH3–CHR–COO−. На этом участке кривой титрования наблюдается «плато»: добавления щелочи не приводит к существенному изменению рН раствора. Это связано с нейтрализацией вносимой щелочи активно высвобождающимися из аланина протонами.
После участка «плато» в растворе начинают преобладать молекулы аминокислоты с депротонированной -карбоксильной группой и при дальнейшем титровании при рН 6,01 (точка перегиба кривой) молекулы аланина достигают изоэлектрической точки, то есть находятся в виде биполярного иона (цвиттериона) +NH3–CHR–COO−.
На второй стадии титрования, при приближении значения рН к 9,69 (численно равном величине рК2 аминогруппы) происходит диссоциация протона от -аминогруппы аланина и при рН 9,69 в растворе присутствуют в эквимолярных концентрациях ионы +NH3–CHR–COO– и NH2–CHR–COO−. На этом участке кривой титрования наблюдается второе «плато», после чего в растворе начинает преобладать полностью депротонированная форма аминокислоты. Титрование завершается приблизительно при рН 12, когда практически все молекулы аланина находятся в форме полностью депротонированных ионов: NH2–CHR–COO−.
Из кривой титрования аланина можно сделать вывод, что данная аминокислота проявляет буферные свойства в двух областях рН. Одна из них определяется сравнительно плоским участком кривой по обе стороны от точки, соответствующей рК1. Другая буферная зона расположена между значениями рН 8,7 и 10,7. Необходимо отметить, что при значении рН = 7,4, характерном для межклеточной жидкости и крови, аланин не проявляет буферные свойства.
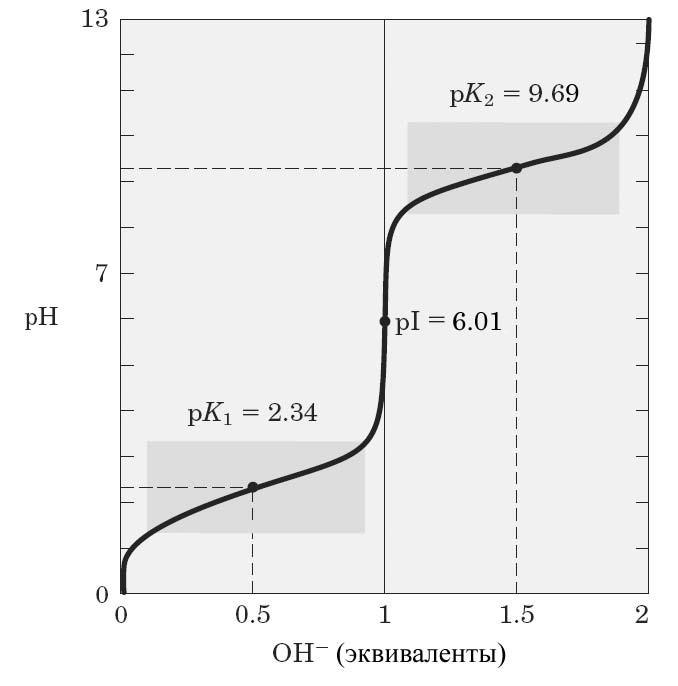
Рис. 1.7. Кривая титрования 0,1 М раствора аланина 0,1 М раствором NaOH.
Аминокислоты, с диссоциирующими группами в радикале, имеют более сложные кривые титрования, складывающиеся из трех участков, соответствующих трем возможным стадиям ионизации (рис. 7 и 8), и следовательно, они имеют три значения рК (рК1, рК2, рКR). Изоэлектрические точки для таких аминокислот определяются типом присутствующей ионизируемой группы в радикале.
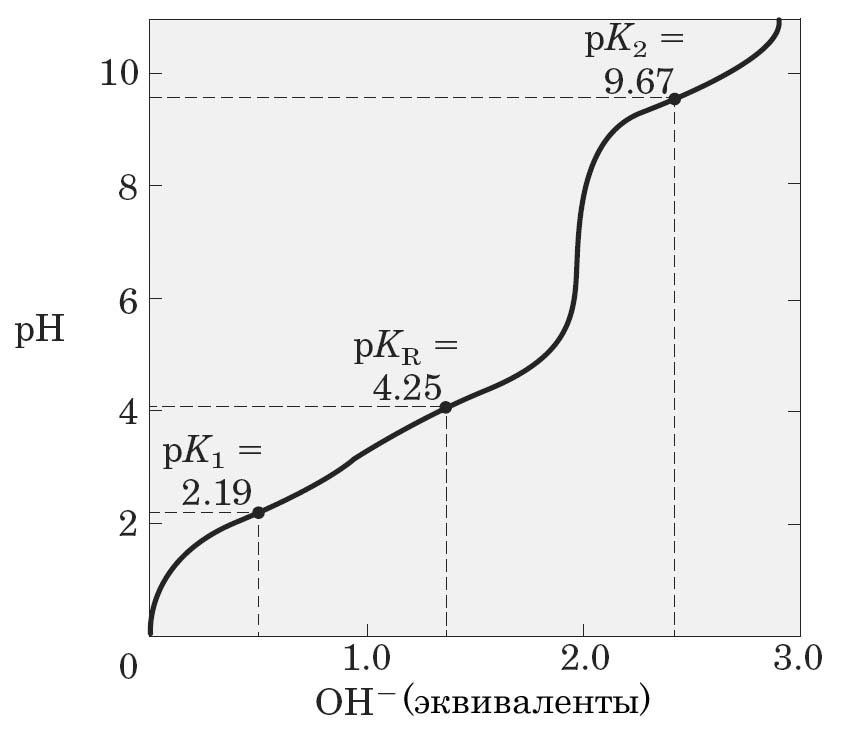
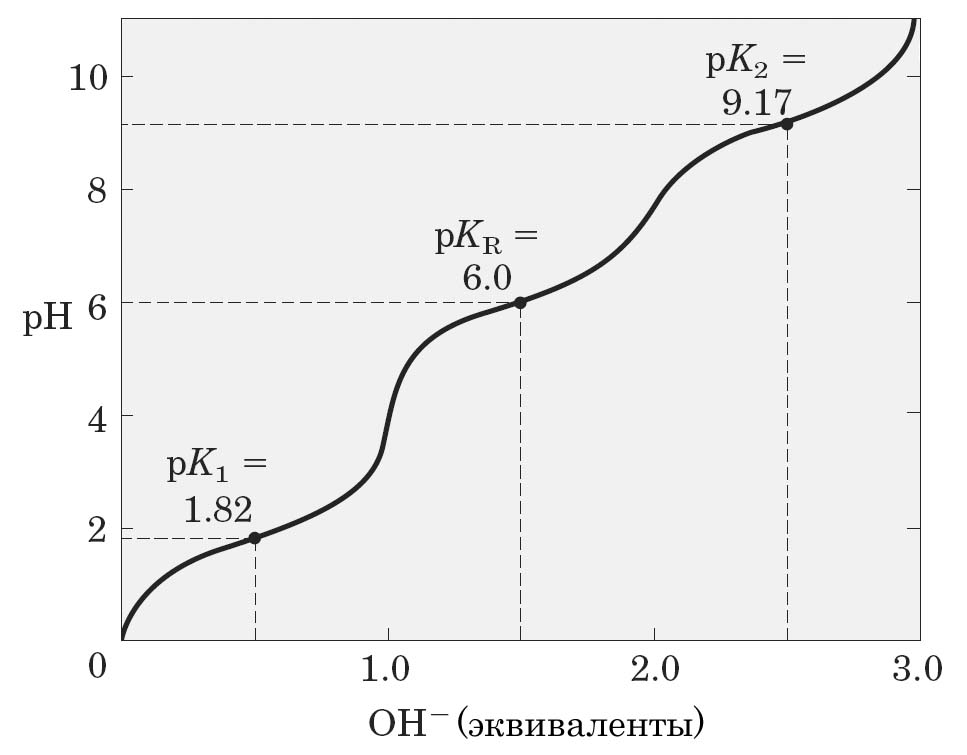
Рис. 1.8. Кривая титрования глутаминовой Рис. 1.9. Кривая титрования гистидина.
кислоты.
Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов с протонированной аминогруппой и диссоциированной карбоксильной группой. При значениях рН, близких к величинам их рК (т.е. при рН 1,7-3,2 и 8,6-10,8), аминокислоты обладают буферными свойствами.
Большое биологическое значение имеет поведение гистидина в качестве буфера. Это единственная аминокислота, которая обладает буферными свойствами в физиологической области рН.
Спектральные свойства. Все аминокислоты поглощают свет в инфракрасной области спектра. Три ароматические аминокислоты (фенилаланин, тирозин и триптофан) поглощают свет в ультрафиолетовой области в диапазоне 260-290 нм (рис. 1.10).
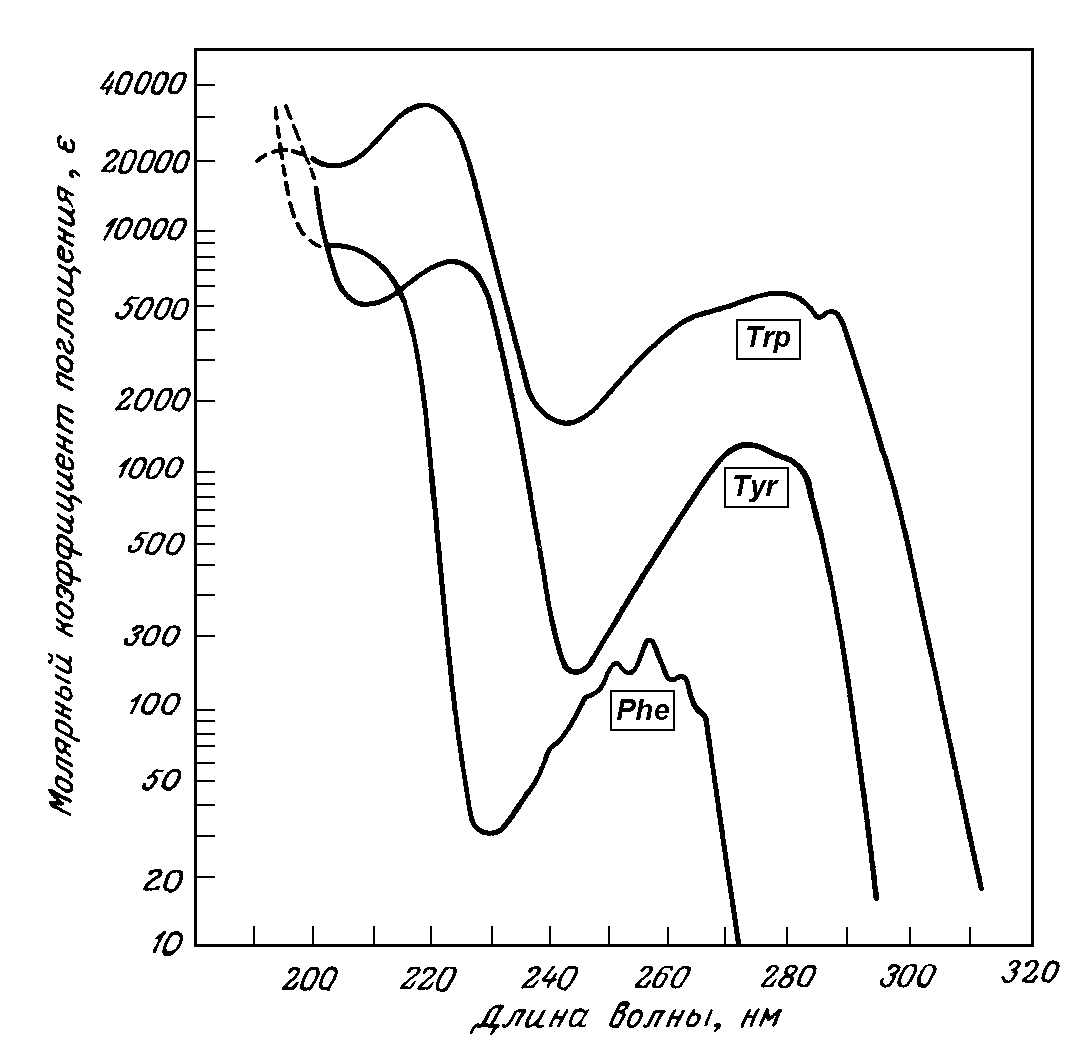
Рис. 1.10. Спектры поглощения ароматических аминокислот
Химические свойства аминокислот. Функциональные амино- и карбоксильные группы аминокислот вступают во все характерные для них реакции.
