
- •Часть I
- •Содержание
- •Лабораторная работа № 1
- •Аминокислоты
- •Реакции аминокислот, обусловленные одновременным присутствием карбоксильных и аминогрупп:
- •Реакции аминокислот, обусловленные присутствием карбоксильных групп:
- •Реакции аминокислот, связанные с присутствием аминогрупп:
- •Методы разделения и идентификации аминокислот
- •Пептиды
- •Реакция с формальдегидом
- •Реакция Адамкевича
- •Реакция Гопкинса-Коле
- •Лабораторная работа № 2
- •Физико-химические свойства белков
- •Лабораторная работа № 3
- •Сложные белки
- •Выделение казеина
- •Определение фосфорной кислоты в казеине
- •Гемопротеиды
- •Гемоглобин
- •Качественная реакция на гемовую группу. Бензидиновая проба
- •Методы количественного определения белка
- •Биуретовый метод Таблица 1
- •Метод Лоури Таблица 2
- •Метод Брэдфорд Таблица 3
- •Приложение Строение и номенклатура протеиногенных аминокислот
- •Классификация аминокислот по строению радикала.
- •Практикум по общей и экологической биохимии
- •Часть I
- •220009 Минск
Качественная реакция на гемовую группу. Бензидиновая проба
При добавлении к дефибринизированной крови растворов бензидина и Н2О2 развивается окраска от зеленного до синего тона, что связано с окислением бензидина пероксидом водорода в присутствии гемоглобина.
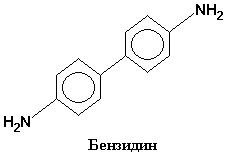
В обычных условиях эта реакция идет крайне медленно, но под действием катализаторов – мгновенно. Гем обладает каталитической активностью, резко ускоряющей окисление бензидина в присутствии Н2О2. Реакция очень чувствительна и под названием бензидиновой пробы на кровь используется в судебно-медицинской экспертизе.
Методы количественного определения белка
Для количественного определения белка в препаратах применяют химические, физические и биологические методы. Наиболее распространенным химическим методом количественного определения белков является колориметрический (спектрофотометрический) метод. Он основан на измерении интенсивности окраски, развивающейся при взаимодействии белков с тем или иным специфическим реагентом. Колориметрия является основой для количественного определения белка биуретовым методом, а также методами Лоури и Брэдфорд.
Биуретовой метод определения белка является достаточно точным в тех случаях, когда содержание белка в исследуемом образце достаточно велико (не ниже нескольких мг/мл). Специфичность данного метода заключается в том, что биуретовый реагент выявляет пептидные связи (см. лабораторную работу №1). Биуретовая реакция чувствительна к температуре. Ее повышение увеличивает скорость развития окраски. Поэтому для получения воспроизводимых результатов, при количественном определении белка биуретовым методом, анализируемые пробы необходимо инкубировать при одной и той же температуре.
Метод лоури долгое время был наиболее распространенным методом количественного определения белка в силу своей высокой чувствительности. В основе метода лежат две цветные реакции на белок: биуретовая реакция и реакция Фолина на остатки тирозина и цистеина в белковой молекуле. Поэтому метод Лоури позволяет осуществлять определение белков в сильно разбавленных растворах, где их количество выражается десятками микрограммов.
Метод Брэдфорд, в отличие от двух предыдущих, является самым точным и чувствительным. Он основан на способности красителя – Кумасси бриллиантового синего G-250 – существовать в двух цветовых формах: красной и синей. В результате взаимодействия с белком красная форма красителя приобретает синее окрашивание за счет образования комплекса белок-краситель. Комплекс протеин-краситель имеет высокий коэффициент экстинкции, определяющий высокую чувствительность метода. Другим важным преимуществом метода Брэдфорд является быстрое развитие окраски (около 2 мин), поэтому весь анализ занимает непродолжительное время. Метод удобен для серийных анализов и адаптирован к автоматическим анализаторам.
Спектрофотометрический метод основан на способности ароматических аминокислот (фенилаланина, тирозина и триптофана) поглощать ультрафиолетовый свет при 280 нм. Поскольку белки отличаются по содержанию ароматических аминокислот, их поглощение в ультрафиолетовой области спектра может сильно различаться. Измеряя величину оптической плотности при этой длине волны, определяют количество белка в растворе.
Контрольные вопросы
Основные принципы организации сложных белков.
Гемопротеиды: гемоглобин – важнейший представитель гемопротеидов.
Методы выделения гемоглобина, качественная реакция на гемовую группу.
Фосфорпотеиды: строение и роль в организме.
Методика выделения казеина, обнаружение фосфорной кислоты в казеине.
Абсорбционная спектроскопия.
Методы количественного определения белка.
Литература
Lowry O.H., Rosebrough N.J., Farr A.L., Randall A.L., Protein measurement with the Folin phenol reagent, J. Biol. Chem., 1951, 193, 265-275
Bradford М., A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Anal. Biochem., 1976, 72, 248 – 254
Овчинников Ю.А., Биоорганическая химия, «Просвещение», М., 1987
Марри Р., Греннер Д., Мейес П., Родуэлл В., Биохимия человека, т. 1, «Мир», М., 1993
Степанов В.М., Молекулярная биология: структура и функции белков, под ред. академика Спирина А.С., «Высшая школа», М., 1996
Кнорре Д.Г., Мызина С.Д., Биологическая химия, «Высшая школа», М., 1998
Кольман Я., Рем К.-Г., Наглядная биохимия, «Мир», М., 2000
Чиркин А.А., Практикум по биохимии, «Новое знание», Минск, 2002.
Кухта В.К., Морозкина Т.С., Олецкий Э.И., Таганович А.Д., Биологическая химия, «Бином», М., 2008.
Горячковский А.М., Справочное пособие по клинической биохимии, «ОКФА», Одесса, 1994.
Дополнительная литература
Nelson D.L., Cox M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004.
Metzler D., Biochemistry, (The chemical reactions in living cells), Elsevier, Academic Press, V. 1-2, 2003-2004.
Berg J.M., Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006.
Ход работы
Цель работы: |
Изучение принципиальных подходов и отработка методик, используемых при выделении и очистке белков Овладение методами количественного определения белка в биологическом материале: биуретовый метод, методы Лоури и Бредфорд |
|
|
Задание I |
Выделение и характеристика гемоглобина. |
Получение кристаллического оксигемоглобина
К 10 мл крови приливают 2 мл смеси воды и эфира (1:1) и содержимое перемешивают до полного гемолиза.
К полученному гемолизату при перемешивании добавляют равный объем (12 мл) насыщенного раствора сульфата аммония.
Выпавший осадок белков удаляют центрифугированием в течение 15 мин при 3000 об/мин или фильтрованием на бумажном фильтре.
Полученный супернатант или фильтрат оставляют на холоду в закрытом сосуде в течение суток до появления в растворе призм и пластинок красного цвета.
Бензидиноваяпроба
Три капли дефибринизированной крови разводят водой до 2 мл.
К полученному раствору приливают равный объем раствора бензидина и перемешивают.
Далее в пробирку добавляют 5 капель 3% раствора перекиси водорода.
Записывают наблюдаемые изменения и объясняют результат.
Задание II |
Выделение и характеристика казеина. |
Выделение казеина из молока
30 мл снятого молока разбавляют четырьмя объемами воды.
К полученному препарату при помешивании добавляют по каплям 0.1% раствор уксусной кислоты до прекращения выпадения осадка казеина (избегать избытка кислоты, так как казеин в сильнокислой среде растворяется!).
Осадок казеина отфильтровывают и промывают водой.
Для отделения жиров и других соединений казеин растворяют в 0.1% растворе карбоната натрия. При этом казеин переходит в раствор, а жиры остаются во взвешенном состоянии.
Смесь фильтруют используя влажный фильтр, при этом жиры остаются на фильтре.
К фильтрату, представляющему собой раствор натриевой соли казеина снова добавляют 0.1% раствор уксусной кислоты.
Полученный осадок казеина отфильтровывают, отжимают между листами фильтровальной бумаги, по возможности, досуха.
Подсушенный казеин обезвоживают посредством растирания в ступке с 20 мл спирта.
Затем для полного удаления жиров казеин встряхивают в большой пробирке сначала с эфиром, а затем с 20 мл смеси метилового спирта и хлороформа (1:1).
Очищеный казеин высушивают на воздухе до получения белого порошка.
Определение остатков фосфорной кислоты в казеине
Приготовление образца:
Навеску казеина (0.05 г) смешивают в тугоплавкой пробирке с 0.3 мл (5 каплями) концентрированной серной кислоты и таким же количеством азотной кислоты.
Пробирку нагревают в песочной бане. Смесь обугливается и при дальнейшем нагревании приобретает бурую окраску.
Через 10 мин, если раствор не обесцвечиватся, добавляют еще 2 капли азотной кислоты и продолжают нагревание. Эту процедуру повторяют до полного обесцвечивания смеси.
Затем добавляют 2 мл воды и продолжают нагревание для удаления оставшейся азотной кислоты
После этого смесь нейтрализуют используя для контроля индикаторную бумагу. Нейтрализацию осуществляют добавлением по каплям 5 М раствора гидроксида натрия (при добавлении избытка щелочи, ее нейтрализуют 1-2 каплями 10 М раствора серной кислоты).
Реакция открытия фосфорной кислоты молибдатом аммония:
К 2 мл молибденового реактива (раствора молибдата аммония в азотной кислоте) прибавляют 1 мл анализируемого раствора.
Смесь нагревают до кипения и кипятят 2-3 мин.
Записывают наблюдаемые изменения и объясняют результаты.
Задание III |
Построение калибровочных графиков для количественного определения белка в биологическом материале биуретовым методом, методами Лоури и Бредфорд |
Количественное определение белка биуретовым методом
В соответствии с табл. 1 готовят ряд разведений исходного раствора белка, содержащего 10 мг бычьего сывороточного альбумина в 1мл.
В каждую пробирку, содержащую 0,2-1 мг белка в 1мл, а так же к 1 мл исследуемого образца добавить по 4 мл биуретового реактива.
Смеси инкубируют при комнатной температуре в течение 30 минут.
Регистрируют оптическую плотность проб на спектрофотометре при 540 (560) нм. В качестве контроля используют раствор, состоящий из 1мл воды и 4 мл биуретового реактива.
Строят калибровочный график зависимости оптической плотности от концентрации белка.
Концентрацию белка в исследуемом образце определяют по калибровочному графику.
