
- •Часть I
- •Содержание
- •Лабораторная работа № 1
- •Аминокислоты
- •Реакции аминокислот, обусловленные одновременным присутствием карбоксильных и аминогрупп:
- •Реакции аминокислот, обусловленные присутствием карбоксильных групп:
- •Реакции аминокислот, связанные с присутствием аминогрупп:
- •Методы разделения и идентификации аминокислот
- •Пептиды
- •Реакция с формальдегидом
- •Реакция Адамкевича
- •Реакция Гопкинса-Коле
- •Лабораторная работа № 2
- •Физико-химические свойства белков
- •Лабораторная работа № 3
- •Сложные белки
- •Выделение казеина
- •Определение фосфорной кислоты в казеине
- •Гемопротеиды
- •Гемоглобин
- •Качественная реакция на гемовую группу. Бензидиновая проба
- •Методы количественного определения белка
- •Биуретовый метод Таблица 1
- •Метод Лоури Таблица 2
- •Метод Брэдфорд Таблица 3
- •Приложение Строение и номенклатура протеиногенных аминокислот
- •Классификация аминокислот по строению радикала.
- •Практикум по общей и экологической биохимии
- •Часть I
- •220009 Минск
Выделение казеина
Наиболее доступным для изучения фосфопротеидом является белок молока – казеин. Вследствие присутствия фосфатной группы он обладает кислыми свойствами и в молоке находится в виде кислой кальциевой соли. Чаще всего казеин выделяют путем подкисления молока. Эта процедура основана на том, что казеин является гидрофобным белком, лишенным гидратной оболочки, поэтому в изоэлектрической точке (слабокислая среда) он становится крайне нестабильным и выпадает в осадок (см. лабораторную работу №2).
Определение фосфорной кислоты в казеине
Обнаружение фосфорной кислоты в белках, в том числе в составе казеина можно осуществить с использованием молибдата аммония или магнезиальной смеси.
Фосфорная кислота образует с молибденовым реактивом желтый кристаллический осадок фосфорномолибденовокислого аммония:
H3PO4 + 12 (NH4)2MoO4 + 21 HNO3 → (NH4)3PO4·12MoO3 +
+ 21 NH4NO3 + 12 H2O.
Реакция с магнезиальной смесью основана на образовании кристаллического осадка фосфата магний-амония MgNH4PO4 в ходе двух последовательных реакций: образования фосфата аммония и взаимодействия данной соли со смесью хлорида магния и хлорида аммония.
Гемопротеиды
Гемсодержащие белки участвуют в процессах транспорта электронов, транспорта кислорода, фотосинтеза. Классическими представителями сложных белков этой группы являются миоглобин и гемоглобин. На примере этих гемопротеидов можно четко проследить связь между структурой и функцией глобулярных белков. Данные гемопротеиды содержат в качестве простетической группы гем – циклический тетрапиррол, включающий атом железа, присутствие которого объясняет красный цвет данных белков и их способность запасать кислород (миоглобин) или обеспечивать его транспорт (гемоглобин). Тетрапирролы состоят из четырех молекул пиррола (рис. 3.1), связанных между собой четырьмя -метиновыми мостиками, что обеспечивает образование плоской (планарной) кольцевой структуры, несущей в определенных положениях соответствующие заместители.
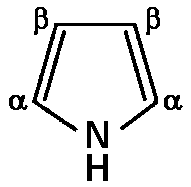
Рис. 3.1 Структурная формула пиррола.
В тетрапиррольных структурах могут присутствовать разные -заместители представленные метильными (М), винильными (V) и пропионатными (Pr) группами. Например, в составе гема указанные заместители расположены в следующем порядке: M, V, M, V, M, Pr, Pr, M (рис. 3.2).
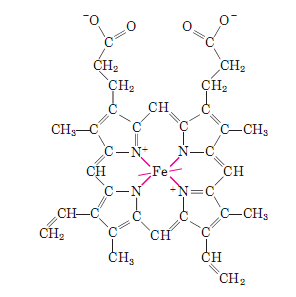
Рис. 3.2. Структура гема.
В центре плоского тетрапиррольного кольца находится один атом железа в ферро-(Fe2+)-состоянии. Похожие по строению простетические группы, содержащие ионы металлов, обнаруживают и в других белках: цитохромах, хлорофилл-содержащих белках (Mg2+) и некоторых ферментах, например, каталазе, триптофанпирролазе и других. В цитохромах происходит циклическое окисление и восстановление атома железа (Fe2+ ↔ Fe3+), играющее определяющую роль в их функционировании. Напротив, окисление Fe2+ до Fe3+ в миоглобине или гемоглобине сопровождается потерей их биологической активности.
Миоглобин
Миоглобин, содержащийся в клетках скелетных мышц, запасает кислород в связанном состоянии и способствует его передаче в митохондрии, которые в процессе окисления поступающих в клетку питательных веществ кислород потребляют и генерируют АТР необходимый для мышечного сокращения. Миоглобин в пять раз быстрее, чем гемоглобин связывает кислород (другими словами имеет более высокое сродство к кислороду, чем гемоглобин).
Миоглобин состоит из единичной полипептидной цепи, состоящей из 153 аминокислотных остатков и одной гемо-группы (рис. 3.3). В результате проведенного рентгеноструктурного анализа было сделано несколько важных выводов относительно организации молекулы этого гемопротеида:
75% полипептидной цепи находится в конформации -спирали (все -спирализованные участки являются правозакрученными). Обнаружено 8 основных участков спирализации, которые обозначены первыми буквами латинского алфавита: А, B, C, D, E, F, G и H. Спирализованные участки разделены 5 неспирализованными участками; такие же неспирализован-ные области находятся на концах цепи.
Молекула миоглобина настолько компактна, что внутри нее может уместиться всего четыре молекулы воды.
Все полярные радикалы, за исключением двух (два остатка гистидина принимают участие в связывании кислорода), расположены на внешней поверхности молекулы.
Большая часть гидрофобных радикалов расположена внутри молекулы миоглобина и таким образом защищены от соприкосновения с водой.
Каждый из четырех остатков пролина в молекуле миоглобина находится в месте изгиба полипептидной цепи. В других местах изгиба или поворотацепи расположены остатки серина, треонина и аспарагина.
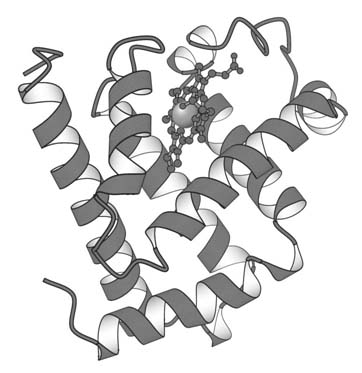
Рис. 3.3. Пространственная модель молекулы миоглобина
