
- •2. Сырьё химической промышленности. Вода.
- •2.1. Понятие о сырье. Виды и классификация сырья
- •2.1.1. Классификация сырья
- •2.1.1.1. Рудное минеральное сырьё
- •2.1.1.2. Нерудное минеральное сырьё
- •2.1.1.3. Горючее минеральное сырьё
- •2.1.1.4. Сырьё растительного и животного происхождения
- •Требования к сырью
- •2.2. Вода. Характеристика природных вод
- •2.2.1. Водные ресурсы и химическая технология
- •2.2.2. Качество воды и требования к ней.
- •Общая схема водоподготовки
- •2.3. Питьевая вода. Очистка питьевой воды
- •Жесткость воды
- •2.3.1. Очистка питьевой воды
- •2.3.1.1. Отстаивание
- •2.3.1.2. Коагуляция
- •2.3.1.2.1. Механизм коагуляции коллоидных частиц
- •2.3.1.2.2. Химические методы удаления временной жёсткости
- •2.3.1.3. Фильтрация
- •2.3.1.4. Обеззараживание
- •Промышленная водоподготовка
- •2.4. Подготовка промышленной воды
- •2.4.1. Умягчение – защита от выпадения солей жесткости
- •2.4.1.1. Физические методы умягчения воды
- •2.4.1.2. Химические методы умягчения воды
- •2.4.1.3. Физико-химические методы умягчения воды
- •2.4.1.3.1. Механизм действия ионитов
- •2.4.2. Обессоливание
- •2.5. Деаэрация или дегазация
- •Водооборотные циклы химических производств.
2.2.2. Качество воды и требования к ней.
Природная вода недостаточно чистая и без соответствующей обработки не может быть использована ни для хозяйственного, ни для промышленного водоснабжения.
Все примеси, присутствующие в воде можно разделить на три группы:
а) грубодисперсные взвеси, с размером частиц более 100 Å;
б) коллоидные частицы, с размером частиц от 1 до 100 Å;
в) молекулярно-дисперсные частицы или истинные растворы, размером менее 1 Å, в том числе, растворы солей, которые отвечают за показатель «минерализация воды.».
В 1 л пресной воды, как правило, содержится около 1 г солей. В морской воде их значительно больше: в водах Балтийского моря - 5 г/л, Черного моря - 18 г/л, в океане - 35 г/л.
Содержание растворенного кислорода в воде определяется ее температурой и реакциями, протекающими в водной среде: фотосинтеза (содержание кислорода увеличивается) и окисления органических соединений - химического и микробиологического (содержание кислорода уменьшается). На 1 г сухого органического вещества в среднем расходуется 1,5 г кислорода в зависимости от состава вод меняется рН. Для рек и озер этот показатель колеблется в пределах 5,0-8,5.
Таким образом, перед использованием воды необходимо очистить ее от примесей, иначе говоря, провести ВОДОПОДГОТОВКУ.
Воду в зависимости от назначения подразделяют на питьевую и промышленную.
Способы водоподготовки питьевой и промышленной воды могут различаться.
Общая схема водоподготовки
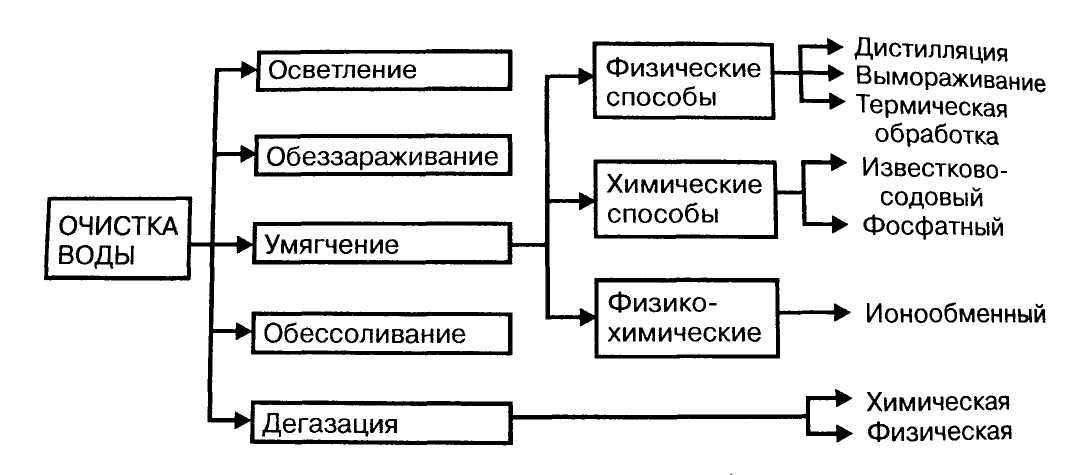
Рис. 2.2 – схема водоподготовки.
2.3. Питьевая вода. Очистка питьевой воды
Для оценки качества питьевой воды используют биологические и физико-химические параметры. К ним относятся: бактериальная загрязнённость, вкус, цвет, запах и жёсткость.
Бактериальная загрязнённость подразумевает:
- общее число бактерий - не более 100 шт./мл;
- кишечной палочки - не более 3 шт./л;
- общее содержание солей не должно превышать 1000 мг/л.
Жесткость воды
Более подробно остановимся на такой важной характеристике как жёсткость воды.
!!! Жёсткостью называется свойство воды, обусловленное присутствием в ней солей кальция (Ca2+) и магния (Mg2+).
В зависимости от природы анионов различают:
а) временную жёсткость или карбонатную жёсткость, зависящую от наличия карбонат-ионов (HCO3-);
б) постоянную или некарбонатную жёсткость, обусловленную наличием хлорид-, нитрат-, сульфат-ионов;
в) общую жёсткость.
1) Временная жёсткость воды удаляется кипячением, в результате чего растворимые гидрокарбонаты переходят в нерастворимые карбонаты и выпадают в виде плотного осадка:
100ºC
Ca(HCO3)2 == CaCO3↓ + H2O + CO2
100ºC
2Mg(HCO3)2 == MgCO3↓ + Mg(OH)2 + H2O + 3CO2
2) Постоянная жёсткость обусловлена присутствием других солей кальция и магния, не удаляемых из воды при кипячении.
3) Сумма временной и постоянной жёсткости называется общей жёсткостью, измеряемой в миллиграмм-эквивалентах ионов кальция или магния в литре воды.
Жёсткость воды равна 1 мг-экв, если в 1 л воды содержится:
- 20,04 мг Ca2+
или
- 12,16 мг Mg2+
По жёсткости природные воды классифицируют в зависимости от содержания Ca2+ или Mg2+ в 1 л воды (в мг-экв):
Очень мягкая 0 - 1,5
Мягкая 1,5 - 3
Умеренно жёсткая 3 - 6
Жёсткая 6 - 10
Очень жёсткая > 10
Для очистки воды применяют следующие методы:
- отстаивание,
- коагуляцию,
- фильтрование,
- обеззараживание,
- умягчение,
- обессоливание,
- деаэрацию или дегазацию.
