
- •Міністерство освіти і науки україни
- •Теплотехніка Теоретичні, практичні та довідкові матеріали Навчально-методичний посібник для самостійного опанування
- •Ардашев в.О., п’ятак о.В. “Теплотехніка. Теоретичні, практичні та довідкові матеріали”. Навчально-методичний посібник для самостійного опанування. – Херсон, хнту, 2008. - 188 с.
- •1. Параметри стану робочих тіл
- •1.1. Основні розрахункові рівняння
- •У бас: Од. Маси – 1 фунт (lbm). Сила - паундаль
- •Для двох різних станів газу
- •Газові суміші
- •Ентропія суміші
- •Ентропія змішування
- •Розв’язання задач
- •1.3. Задачі для самостійного розв’язання
- •Питання для самоперевірки та контролю засвоєння знань
- •2. Перший та другий закони термодинаміки
- •2.1.Основні розрахункові рівняння
- •2.1.1. Перший закон
- •2.1.2. Другий закон
- •2.2. Розв’язання задач
- •Незалежність теплоємності від температури
- •Лінійна залежність
- •3. Нелінійна залежність
- •2.3. Задачі для самостійного розв’язання
- •Питання для самоперевірки та контролю засвоєння знань
- •3. Термодинамічні процеси ідеальних газів
- •Основні розрахункові рівняння
- •Теплоємність суміші газів
- •3.2. Розв’язання задач
- •3.3. Задачі для самостійного розв’язання
- •3.4. Питання для самоперевірки та контролю засвоєння знань
- •4. Термодинамічні процеси водяної пари
- •4.1. Основні розрахункові рівняння
- •4.2. Розв’язання задач
- •Довжина колектора
- •4.3. Задачі для самостійного розв’язання
- •Питання для самоперевірки та контролю засвоєння знань
- •5. Термодинамічні процеси вологого повітря
- •5.1. Основні розрахункові рівняння
- •5.2. Розв’язання задач
- •Кількість вологи у повітрі при початкових параметрах
- •У загальному випадку точка суміші визначається за правилом важеля:
- •1. Визначення параметрів повітря в характерних точках процесу
- •2. Витрати теплоти на нагрівання повітря в калорифері
- •3. Побудова процесів вологого повітря в і-d діаграмі
- •4. Кількість вологи, відібраної від пряжі в сушарці
- •5. Витрати теплоти і кількість відібраної вологи при відсутності процесу змішування потоків повітря
- •5.3. Задачі для самостійного розв’язання
- •Питання для самоперевірки та контролю засвоєння знань
- •6. Цикли теплових двигунів
- •6.1. Прямі і необоротні термодинамічні цикли
- •6.2. Процеси стиснення в компрессорах
- •6.3. Цикли двигунів внутрішнього згоряння
- •6.4. Цикли газотурбінних установок
- •6.5. Цикл Ренкіна паросилової установки
- •6.6. Цикл парокомпресійної холодильної установки
- •6.7. Розв’язання задач
- •1. Розрахунок параметрів стану в характерних точках
- •2. Розрахунок робіт компресора
- •К.К.Д. Компресора та потужність приводу
- •Параметри стиснення в трьохступінчастому компресорі
- •5. Побудова діаграм
- •1. Розрахунок термічних параметрів стану в характерних точках циклу
- •Зображення циклу в р-V і t-s координатах
- •2. Визначення термічного к.К.Д. І роботи циклу
- •3.Порівняння термічного к.К.Д. Циклу гту з термічним к.К.Д. Циклу Карно
- •Побудова циклу в p-V і t-s координатах
- •6. Порівняння термічного к.К.Д. Розрахованого циклу з термічним к.К.Д. Циклу двигуна внутрішнього згоряння
- •Зображення циклу в p-V і т-s координатах
- •Розрахунок параметрів стану в характерних точках циклу
- •Розрахунок кількості теплоти, роботи і зміни внутрішньої енергії в термодинамічних процесах, що складають цикл
- •Визначення термічного і внутрішнього к.К.Д. Циклу
- •4. Порівняння термічного к.К.Д. Даного циклу з термічним к.К.Д. Циклу Карно
- •5. Побудова розрахованого циклу в р-V і т-s координатах
- •6. Розрахунок зміни термічного к.К.Д. Циклу при зміні тиску і температури пари перед турбіною і зниження тиску пари, що відробило, після турбіни
- •7. Розрахунок годинної витрати палива
- •Визначення параметрів стану в характерних точках циклу
- •Розрахунок питомої холодопродуктивності, кількості теплоти, відданої в навколишнє середовище, витрат роботи в компресорі, холодильного коефіцієнта, роботи циклу
- •3. Побудова розрахованого циклу в р-V і т-s координатах
- •4. Побудова залежності холодильного коефіцієнта від витрат роботи в компресорі
- •5. Розрахунок витрати холодильного агента, витрати холодної води на конденсатор і теоретичної потужності приводу компресора
- •6. Побудова циклу холодильної установки в р-I діаграмі
- •6.8. Задачі для самостійного розв’язання
- •6.9. Питання для самоперевірки та контролю засвоєння знань
- •7. Процеси теплопередачі
- •7.1. Основні розрахункові рівняння
- •7.2. Розв’язання задач
- •7.3. Задачі для самостійного розв’язання
- •7.4. Питання для самоперевірки та контролю засвоєння знань
- •8. Конвективні процеси переносу теплоти
- •8.1. Основні розрахункові рівняння
- •8.2. Розв’язання задач
- •Розв’язання: Визначальна температура рідини
- •Визначаємо, чи має місце вплив конвекції на теплообмін у трубі. Визначальна температура
- •Коефіцієнт тепловіддачі від поверхні теплообмінника до повітря
- •Критична густина теплового потоку
- •8.3. Задачі для самостійного розв’язання
- •8.4. Питання для самоперевірки та контролю засвоєння знань
- •9. Процеси теплообміну випромінюванням
- •9.1. Основні розрахункові рівняння
- •9.2. Види променистих потоків
- •9.3. Теплообмін між тілами довільно розміщеними у просторі
- •9.4. Розв’язання задач
- •9.2. Задачі для самостійного розв’язання
- •9.4. Питання для самоперевірки та контролю засвоєння знань
- •10. Теплообмінні апарати
- •10.1. Основні розрахункові рівняння Рівняння теплового балансу:
- •Довжина трубок
- •10.2. Розв’язання задач
- •Живий перетин трубок
- •Еквівалентний діаметр міжтрубного простору
- •Розрахунок
- •Розрахунок коефіцієнта тепловіддачі від гарячої води до стінки труби (міжтрубний простір)
- •Розрахунок коефіцієнта тепловіддачі від стінки до холодної води (внутрішній простір труб)
- •Розрахунок величини поверхні нагрівання
- •Елементи конструктивного розрахунку теплообмінника Довжина трубок поверхні теплообмінника
- •Підбір теплообмінника
- •Характеристика теплообмінника
- •Розрахунок коефіцієнта тепловіддачі від гарячої води до внутрішньої поверхні труби
- •Розрахунок коефіцієнта тепловіддачі від ребристої поверхні до повітря
- •Теплова продуктивність однієї секції калорифера
- •10.3. Задачі для самостійного розв’язання
- •10.4. Питання для самоперевірки та контролю засвоєння знань
- •11. Процеси згоряння палива
- •11.1. Основні розрахункові рівняння
- •11.2. Розв’язання задач
- •11.3. Розв’язання задач самостійно
- •11.4. Питання для самоперевірки та контролю засвоєння знань
- •12. Тепловий баланс котлоагрегата
- •12.1. Основні розрахункові рівняння Теплота, що вноситься в топку котла (розпоряджувальна теплота)
- •Тепловий баланс може бути записаний
- •Розв’язання задач
- •Вихідні дані до складання теплового балансу
- •12.4. Питання для самоперевірки та контролю засвоєння знань
- •Література
- •Додатки
- •Приставки для утворення кратних і часткових одиниць
- •Молекулярні маси, густини та об’єми кіломолей при нормальних умовах і газові сталі найважливіших газів
- •Інтерполяційні формули для середніх масових та об’ємних теплоємностей газів
- •Теплоємність кисню1
- •Теплоємність водяної пари
- •Теплоємність повітря
- •Теплоємність азоту
- •Теплоємність окису вуглецю
- •Теплоємність водню
- •Теплоємність вуглекислого газу
- •Теплоємність сірчистого газу
- •Насичена водяна пара (по температурам) параметри надані в одиницях системи сі
- •Насичена водяна пара (по тискам) параметри надані в одиницях системи сі
- •Вода та перегріта водяна пара параметри надані в одиницях системи сі (числа зліва від східчастої лінії відносяться до води)
- •Густина та парціальний тиски повітря
- •Насичена водяна пара аміаку (нn3)
- •Насичена пара вуглекислоти (со2)
- •Фізичні властивості води на лінії насичення
- •Термодинамічні властивості перегрітої пари фреону-22
- •Значення параметрів а і в при конденсації водяної пари
- •Дані для визначення діаметра d' кожухотрубного теплообмінника
- •Технічна характеристика водоводяних підігрівників
Питання для самоперевірки та контролю засвоєння знань
1. Термічні параметри стану.
Калоричні параметри стану.
Рівняння стану ідеального газу Менделєєва-Клапейрона.
Співвідношення між одиницями виміру тиску.
Одиниці вимірювання тиску в Англії і США.
Співвідношення між температурами по Цельсію і Фаренгейту.
Нормальні фізичні умови.
Масові, об'ємні і мольні частки газової суміші.
Формули для перерахунку масових часток в об’ємні і навпаки.
Ентропія суміші та змішування.
2. Перший та другий закони термодинаміки
2.1.Основні розрахункові рівняння
2.1.1. Перший закон
Теплота Q1-2, що підводиться до тіла у процесі 1-2 витрачається на зміну внутрішньої енергії ΔU1-2 та використання роботи L1-2.
Для газу масою m
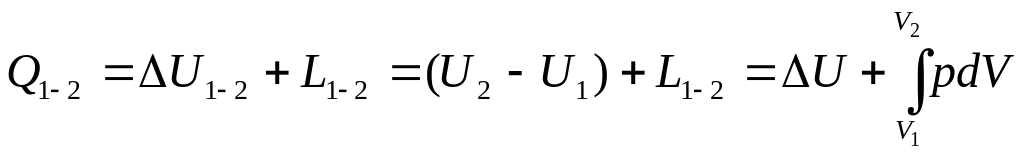 .
.
Для одного кілограму газу

В диференційній формі
![]() ;
;
![]() ;
;
![]()
![]() .
.
Для безкінечно малої зміни стану:
![]()
![]() .
.
Для інтервалу температур:
![]()
![]() ,
,
де ср, сv – істинні масові ізобарна та ізохорна теплоємності;
срm, сvm – середні масові ізобарна та ізохорна теплоємності;
![]() початкова
і кінцева температури тіла.
початкова
і кінцева температури тіла.
Теплоємністю тіла с називають кількість теплоти Q, яку необхідно підвести чи відвести від тіла для зміни температури на один градус,
![]() .
.
Якщо теплота підводиться у процесі з постійним тиском, P=const, то таку теплоємність називають ізобарною, якщо ж у процесі з постійним об’ємом, V=const, то ізохорною. Відповідним теплоємностям присвоюють індекси «p» або «v». Індекс «m» означає, що теплоємність середня і вона визначена для інтервалу температур. Істина теплоємність визначається в межах однієї температури.
Істина |
Середня |
|
|
Питомі теплоємності:
1. Масова – c, кДж/(кг·К); 2. Об’ємна – c´, кДж/(м3·К); 3. Мольна – μc, кДж/(кмоль·К).
Відношення теплоємностей позначають k=cp/cv=μcp/μcv, для одноатомних газів k=1,67; двоатомних, k=1,4; трьох – і багатоатомних, k=1,33. Теплоємність змінюється із зміною температури. Вона може не залежати від температури, мати лінійну або криволінійну залежність.
У випадку, коли теплоємність не залежить від температури, то її визначають,
![]() ;
;
![]() ,
,
де μ – молекулярна маса речовини, кг/моль.
Числові значення мольних теплоємностей вибирають із таблиць у залежності від атомності газу: одноатомні, двоатомні, трьох – і багатоатомні.
Таблиця 1
-
Атомність газу
Мольна теплоємність кДж/кмольК
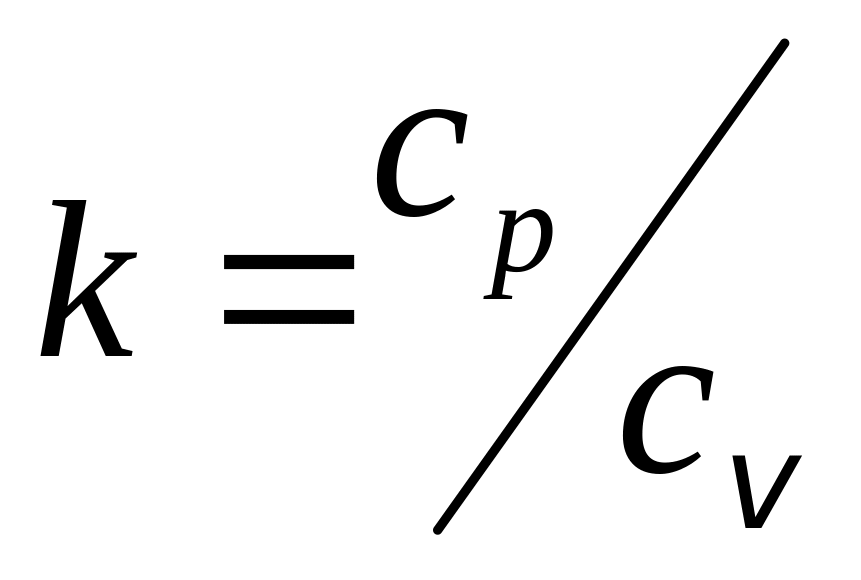
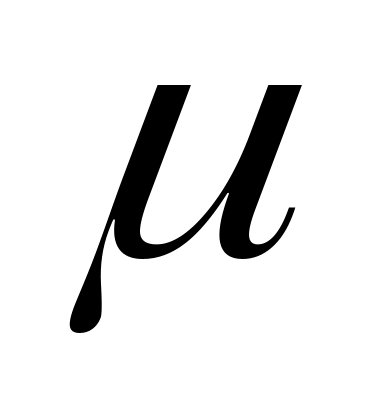 cv
cvcp
Одноатомний
12,5
20,8
1,67
Двохатомний
20,8
29,1
1,4
Багатоатомний
25
33,3
1,33
При лінійній залежності середня теплоємність визначається,
![]()
де a, b – постійні коефіцієнти для даного газу, їх величина наводиться в табл. 4, додатку.
Під
індексом «x»
розуміють вид процесу: ізобарний x=p,
ізохорний x=v.
При нелінійній залежності теплоємності
від температури, що виражається
багаточленом
![]() ,
де a,b,d,е
– постійні коефіцієнти, t
– температура, середня теплоємність
визначається за допомогою таблиць по
формулі:
,
де a,b,d,е
– постійні коефіцієнти, t
– температура, середня теплоємність
визначається за допомогою таблиць по
формулі:
![]()
де сх1, сх2 – теплоємності, які вибирають із таблиць додатку відповідно температурам t1 і t2.
Теплоємність газової суміші:
Масова,
![]() ;
об’ємна,
;
об’ємна,
![]() ;
мольна,
;
мольна,
![]()
де gi, ri – відповідно масові та об’ємні частки компонентів суміші.
Визначена теплоємність дозволяє розрахувати кількість підведеної чи відведеної теплоти. Якщо в процесі приймало участь m, кг або Vн, м3 газу, то
![]() ;
;
![]() ,
,
де Vн – об’єм речовини при нормальних умовах, м3.
Рівняння І закону термодинаміки для потоку
![]() ,
,
де і1, і2 – питома ентальпія потоку речовини в перерізах 1 і 2, Дж/кг;
G – масова втрата речовини, кг/с;
w1, w2 – швидкість потоку в перерізах 1 і 2, м/с;
h1, h2 – висота розміщення центра першого та другого перерізі ввід контрольної поверхні, м;
Lтехн. – технічна робота, яку може виконати потік, Дж/с;
g=9,81 м2/с – прискорення сили тяжіння.
