
- •Міністерство освіти і науки україни
- •Теплотехніка Теоретичні, практичні та довідкові матеріали Навчально-методичний посібник для самостійного опанування
- •Ардашев в.О., п’ятак о.В. “Теплотехніка. Теоретичні, практичні та довідкові матеріали”. Навчально-методичний посібник для самостійного опанування. – Херсон, хнту, 2008. - 188 с.
- •1. Параметри стану робочих тіл
- •1.1. Основні розрахункові рівняння
- •У бас: Од. Маси – 1 фунт (lbm). Сила - паундаль
- •Для двох різних станів газу
- •Газові суміші
- •Ентропія суміші
- •Ентропія змішування
- •Розв’язання задач
- •1.3. Задачі для самостійного розв’язання
- •Питання для самоперевірки та контролю засвоєння знань
- •2. Перший та другий закони термодинаміки
- •2.1.Основні розрахункові рівняння
- •2.1.1. Перший закон
- •2.1.2. Другий закон
- •2.2. Розв’язання задач
- •Незалежність теплоємності від температури
- •Лінійна залежність
- •3. Нелінійна залежність
- •2.3. Задачі для самостійного розв’язання
- •Питання для самоперевірки та контролю засвоєння знань
- •3. Термодинамічні процеси ідеальних газів
- •Основні розрахункові рівняння
- •Теплоємність суміші газів
- •3.2. Розв’язання задач
- •3.3. Задачі для самостійного розв’язання
- •3.4. Питання для самоперевірки та контролю засвоєння знань
- •4. Термодинамічні процеси водяної пари
- •4.1. Основні розрахункові рівняння
- •4.2. Розв’язання задач
- •Довжина колектора
- •4.3. Задачі для самостійного розв’язання
- •Питання для самоперевірки та контролю засвоєння знань
- •5. Термодинамічні процеси вологого повітря
- •5.1. Основні розрахункові рівняння
- •5.2. Розв’язання задач
- •Кількість вологи у повітрі при початкових параметрах
- •У загальному випадку точка суміші визначається за правилом важеля:
- •1. Визначення параметрів повітря в характерних точках процесу
- •2. Витрати теплоти на нагрівання повітря в калорифері
- •3. Побудова процесів вологого повітря в і-d діаграмі
- •4. Кількість вологи, відібраної від пряжі в сушарці
- •5. Витрати теплоти і кількість відібраної вологи при відсутності процесу змішування потоків повітря
- •5.3. Задачі для самостійного розв’язання
- •Питання для самоперевірки та контролю засвоєння знань
- •6. Цикли теплових двигунів
- •6.1. Прямі і необоротні термодинамічні цикли
- •6.2. Процеси стиснення в компрессорах
- •6.3. Цикли двигунів внутрішнього згоряння
- •6.4. Цикли газотурбінних установок
- •6.5. Цикл Ренкіна паросилової установки
- •6.6. Цикл парокомпресійної холодильної установки
- •6.7. Розв’язання задач
- •1. Розрахунок параметрів стану в характерних точках
- •2. Розрахунок робіт компресора
- •К.К.Д. Компресора та потужність приводу
- •Параметри стиснення в трьохступінчастому компресорі
- •5. Побудова діаграм
- •1. Розрахунок термічних параметрів стану в характерних точках циклу
- •Зображення циклу в р-V і t-s координатах
- •2. Визначення термічного к.К.Д. І роботи циклу
- •3.Порівняння термічного к.К.Д. Циклу гту з термічним к.К.Д. Циклу Карно
- •Побудова циклу в p-V і t-s координатах
- •6. Порівняння термічного к.К.Д. Розрахованого циклу з термічним к.К.Д. Циклу двигуна внутрішнього згоряння
- •Зображення циклу в p-V і т-s координатах
- •Розрахунок параметрів стану в характерних точках циклу
- •Розрахунок кількості теплоти, роботи і зміни внутрішньої енергії в термодинамічних процесах, що складають цикл
- •Визначення термічного і внутрішнього к.К.Д. Циклу
- •4. Порівняння термічного к.К.Д. Даного циклу з термічним к.К.Д. Циклу Карно
- •5. Побудова розрахованого циклу в р-V і т-s координатах
- •6. Розрахунок зміни термічного к.К.Д. Циклу при зміні тиску і температури пари перед турбіною і зниження тиску пари, що відробило, після турбіни
- •7. Розрахунок годинної витрати палива
- •Визначення параметрів стану в характерних точках циклу
- •Розрахунок питомої холодопродуктивності, кількості теплоти, відданої в навколишнє середовище, витрат роботи в компресорі, холодильного коефіцієнта, роботи циклу
- •3. Побудова розрахованого циклу в р-V і т-s координатах
- •4. Побудова залежності холодильного коефіцієнта від витрат роботи в компресорі
- •5. Розрахунок витрати холодильного агента, витрати холодної води на конденсатор і теоретичної потужності приводу компресора
- •6. Побудова циклу холодильної установки в р-I діаграмі
- •6.8. Задачі для самостійного розв’язання
- •6.9. Питання для самоперевірки та контролю засвоєння знань
- •7. Процеси теплопередачі
- •7.1. Основні розрахункові рівняння
- •7.2. Розв’язання задач
- •7.3. Задачі для самостійного розв’язання
- •7.4. Питання для самоперевірки та контролю засвоєння знань
- •8. Конвективні процеси переносу теплоти
- •8.1. Основні розрахункові рівняння
- •8.2. Розв’язання задач
- •Розв’язання: Визначальна температура рідини
- •Визначаємо, чи має місце вплив конвекції на теплообмін у трубі. Визначальна температура
- •Коефіцієнт тепловіддачі від поверхні теплообмінника до повітря
- •Критична густина теплового потоку
- •8.3. Задачі для самостійного розв’язання
- •8.4. Питання для самоперевірки та контролю засвоєння знань
- •9. Процеси теплообміну випромінюванням
- •9.1. Основні розрахункові рівняння
- •9.2. Види променистих потоків
- •9.3. Теплообмін між тілами довільно розміщеними у просторі
- •9.4. Розв’язання задач
- •9.2. Задачі для самостійного розв’язання
- •9.4. Питання для самоперевірки та контролю засвоєння знань
- •10. Теплообмінні апарати
- •10.1. Основні розрахункові рівняння Рівняння теплового балансу:
- •Довжина трубок
- •10.2. Розв’язання задач
- •Живий перетин трубок
- •Еквівалентний діаметр міжтрубного простору
- •Розрахунок
- •Розрахунок коефіцієнта тепловіддачі від гарячої води до стінки труби (міжтрубний простір)
- •Розрахунок коефіцієнта тепловіддачі від стінки до холодної води (внутрішній простір труб)
- •Розрахунок величини поверхні нагрівання
- •Елементи конструктивного розрахунку теплообмінника Довжина трубок поверхні теплообмінника
- •Підбір теплообмінника
- •Характеристика теплообмінника
- •Розрахунок коефіцієнта тепловіддачі від гарячої води до внутрішньої поверхні труби
- •Розрахунок коефіцієнта тепловіддачі від ребристої поверхні до повітря
- •Теплова продуктивність однієї секції калорифера
- •10.3. Задачі для самостійного розв’язання
- •10.4. Питання для самоперевірки та контролю засвоєння знань
- •11. Процеси згоряння палива
- •11.1. Основні розрахункові рівняння
- •11.2. Розв’язання задач
- •11.3. Розв’язання задач самостійно
- •11.4. Питання для самоперевірки та контролю засвоєння знань
- •12. Тепловий баланс котлоагрегата
- •12.1. Основні розрахункові рівняння Теплота, що вноситься в топку котла (розпоряджувальна теплота)
- •Тепловий баланс може бути записаний
- •Розв’язання задач
- •Вихідні дані до складання теплового балансу
- •12.4. Питання для самоперевірки та контролю засвоєння знань
- •Література
- •Додатки
- •Приставки для утворення кратних і часткових одиниць
- •Молекулярні маси, густини та об’єми кіломолей при нормальних умовах і газові сталі найважливіших газів
- •Інтерполяційні формули для середніх масових та об’ємних теплоємностей газів
- •Теплоємність кисню1
- •Теплоємність водяної пари
- •Теплоємність повітря
- •Теплоємність азоту
- •Теплоємність окису вуглецю
- •Теплоємність водню
- •Теплоємність вуглекислого газу
- •Теплоємність сірчистого газу
- •Насичена водяна пара (по температурам) параметри надані в одиницях системи сі
- •Насичена водяна пара (по тискам) параметри надані в одиницях системи сі
- •Вода та перегріта водяна пара параметри надані в одиницях системи сі (числа зліва від східчастої лінії відносяться до води)
- •Густина та парціальний тиски повітря
- •Насичена водяна пара аміаку (нn3)
- •Насичена пара вуглекислоти (со2)
- •Фізичні властивості води на лінії насичення
- •Термодинамічні властивості перегрітої пари фреону-22
- •Значення параметрів а і в при конденсації водяної пари
- •Дані для визначення діаметра d' кожухотрубного теплообмінника
- •Технічна характеристика водоводяних підігрівників
Ентропія суміші
s = s1+ s2+…+sn+sсум.
Ентропія змішування
![]()
Розв’язання задач
Задача № 1. Визначити масу вуглекислого газу в судині об’ємом V=4 м3, при температурі t=80оС. Тиск газу по манометру Pм=0,04МПа, барометричний тиск Pб=103990 Па.
Дано: V = 4 м3; t = 80 оC; Pм= 0,04 МПа; Pб= 103990 Па
m - ?
Розв’язання:
PV = mRT
m = PV/RT
P = Pм + Pб = 0,10399+ 0,04=0,14399 МПа = 143990 Па
![]()
![]()
Задача № 2. У судині знаходиться повітря під розрідженням 10 кПа і температурі 0оС. Ртутний барометр показує Рб=99725 Па при tрт=20оС. Визначити питомий об’єм повітря.
Дано: Рр= 10 кПа = 10000 Па; t = 0оC; Рб= 99725 Па; tрт= 20оC
v - ?
Розв’язання:
Приведення показань ртутного барометра до 0оС:
В0= В (1 – 0,000172t) = 99725 (1 – 0,00017220) = 99382 Па
Рр= Рб- Ра;
Ра= Рб – Рр= 99382 – 10000 = 89382 Па
![]()
![]()
Задача № 3. Розрахувати ентальпію кисню, що знаходиться при t=-50оС і має питому внутрішню енергію u=144,2 кДж/кг. Маса кисню mО2=10 кг.
Дано: t = -50оC; u = 144,2 кДж/кг; mО2= 10 кг
i - ?
Розв’язання:
і = u + Pv
Pv = RT;
![]()
Pv = RT = 259,8 (-50 + 273) = 57935,4 Дж/кг = 57,9 кДж/кг
і = u + Pv = 144,2 + 57,9 = 202,1 кДж/кг
І= і m = 202,1 10 = 2021 кДж
Задача № 4. Газова суміш має такий масовий склад: СО2=38%, N2=62%. Визначити об'ємний склад суміші, уявну молекулярну масу, газову сталу і парціальні тиски компонентів, якщо тиск суміші Рсум=1,2 МПа.
Дано: gСО2= 0,38 = 38%; gN2= 0,62 = 62%; Pcум= 1,2 МПа
rі- ? сум- ? Rсум- ? PСО2- ? PN2- ?
Розв’язання:
![]()
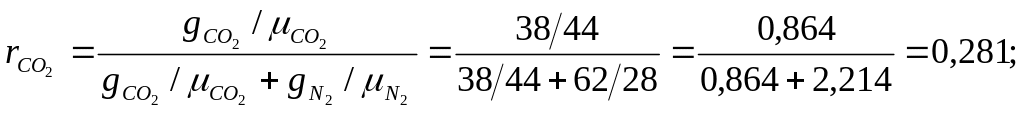
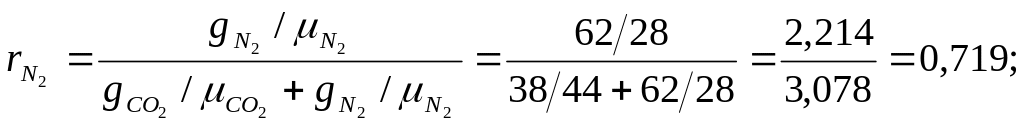
![]()
= 0,28144 + 0,71928 = 32,5 кг/кмоль
Rсум = R/сум= 8314/32,5 = 255,8 Дж/(кгК)
РСО2= rСО2 Pсум= 0,2811,2 = 0,337 МПа
РN2= rN2 Pсум= 0,7191,2 = 0,863 МПа
Рсум= Рі = PСО2+ PN2= 0,337 + 0,863 = 1,2 МПа
1.3. Задачі для самостійного розв’язання
Задача № 1. У циліндричній судині з внутрішнім діаметром d=0,5N м і висотою h=1,5+0,2N; знаходиться газ SO2, масою m=(50+N) кг. Барометричний тиск Pб=101325 Па. Визначити температуру газу в судині. Тиск газу визначається за умовою P=(0,01N+0,005) МПа, при цьому слід врахувати: якщо P<Pб, то газ знаходиться в судині під розрідженням – (вакуум); якщо P>Pб, то газ знаходиться в судині під надлишковим тиском. Що буде показувати мановакууметр, якщо температура газу в судині збільшиться на 20NоC? Виразити тиск газу в мм.рт.ст.; кг/см2; м.вод.ст.; lbf/in2, а температуру в градусах по Фаренгейту.
N – номер прізвища за списком.
Задача № 2. У балоні об’ємом V=0,4 м3 знаходиться повітря при тиску Pн=N кг/см2 і температурі 10N по Фаренгейту. Барометричний тиск Pб=101,325 кПа. Скільки газу необхідно викачати із судини, щоб розрідження в ньому стало Pр=0,001N МПа. Визначити питомий об’єм і густину повітря до і після випуску газу.
Задача № 3. Маса порожнього балона для кисню ємністю V=0,05м3 дорівнює 80кг. Визначити масу балона після його заповнення киснем при t=(20+2N)оC, до тиску Pн=N МПа. Барометричний тиск Pб=99800Па. Як зміниться температура газу, якщо з нього випустити 50% кисню, а тиск понизиться на 40%. Виразити цю температуру в оС, в оF , а тиск після випуску кисню в кг/см2, мм.рт.ст., м.вод.ст.
Задача № 4. Поршневий компресор всмоктує в хвилину Vn=N м3 повітря при t=(15+N)оC і Рб=100 кПа і нагнітає його в резервуар Vр=N м3. За скільки хвилин компресор підніме тиск у резервуарі до Рк=N МПа, якщо температура в ньому буде залишатися постійною. Початковий тиск повітря в резервуарі Рб=100 кПа, при температурі t. Виразити Рк у бар, мм.рт.ст., кг/см2, м.вод.ст., lbt/in2, t в оF.
Задача № 5. Резервуар масою mр=20N кг і об’ємом V=(4+N) м3 заповнений вуглекислим газом. Визначити, з якою силою діє резервуар на балку перекриття, а газ на дно резервуара, якщо діаметр циліндричного резервуара dр=(2+0,2N) м, а газ знаходиться при надлишковому тиску Рр=0,5N МПа і t=(30+2N)оC. Барометричний тиск повітря Рб=102,4 кПа. Виразити тиск в бар, мм.рт.ст., м.вод.ст., кг/см2, lbt/in2, а t в оF.
Задача № 6. Визначити підйомну силу повітряної кулі, наповненої воднем, якщо її об’єм Vк=N м3, тиск Р=101325 Па, температура водню tН2=(50+3N)оС, температура навколишнього повітря t =NоС.
Задача № 7. Аналіз продуктів згоряння палива показав їхній об'ємний склад rSO2=N%, rО2=2N%, rН2=100–(rSO2+rО2). Визначити масові частки компонентів суміші, уявну молекулярну масу, газову сталу, густину і парціальний тиск компонентів суміші при t=20оС і Рб=0,101 МПа.
Задача № 8. Димові гази мають такий масовий склад gСО2=N%, g2=2N%, gН2О=100–(gСО2+gN2). Визначити об'ємні частки компонентів, уявну молекулярну масу, газову сталу, питомий об’єм і парціальні тиски при t=30оС і Рб=101325 Па.
Задача № 9. Визначити масовий склад газової суміші, що складається з аргону і гелію, якщо парціальний тиск РAr=(100+5N) кПа, тиск суміші Рсум=500 кПа. Розрахувати газову сталу, уявну молекулярну масу і густину суміші при t=NоС, маси компонентів, якщо маса суміші mсум=2N кг.
Задача № 10. Розрахувати внутрішню енергію повітря при температурі t=5NоC і ентальпії i=100N кДж/кг, маса повітря m=2N кг.
Задача № 11. Розрахувати ентальпію двоокису вуглецю при t=3NоC, якщо внутрішня енергія u=(150+2N) кДж/кг, маса газу mСО2=5N кг.
Задача № 12. Визначити питомий об’єм азоту, якщо він знаходиться при тиску P=(100000+500N) Па. Питома ентальпія азоту і=(304+5N) кДж/кг, а питома внутрішня енергія u=(217+3N) кДж/кг.
Задача № 13. Розрахувати ентропію повітря масою m=(5+N) кг, що знаходиться в судині, об’ємом V=(0,5+0,2N) м3, при температурі t=(20+5N)оC. Ізобарна теплоємність повітря ср=1,005 кДж/(кгК).
Задача № 14. Суміш газів складається з (5+N) кг двоокису вуглецю з ентропією sСО2=4,89 кДж/кгК; (10+N) кг водяної пари з ентропією sН2О=10,5 кДж/кгК. Визначити ентропію суміші.
Задача № 15. 1 кг повітря при температурі t1=(100+N)оC розширюється до десятикратного об’єму, при цьому його температура падає до t2=(10+N)оС. Визначити зміну ентропії, якщо ізохорна теплоємність повітря сv=0,75 кДж/(кгК).
Задача № 16. Ідеально-газова суміш задана мольними частками zО2=2N%, zSO2=1,5N%, zCO=100–(z2+zSO2). Визначити масові частки, уявну молекулярну масу суміші, газову сталу, густину при тиску Рcум=1,2 МПа і температурі t=50оС, масу суміші і маси компонентів, якщо сумарна кількість молів Мсум=2N.
Задача № 17. Газ коксових печей має такий об'ємний склад: H2=(40+N)%, CH4=(15+0,5N)%, N2=100–(H2+CH4)%. Визначити уявну молекулярну масу, масові частки, газову сталу, густину і парціальні тиски при температурі t=NоC і тиску Р=(100+5N) кПа.
Задача № 18. Знайти газову сталу, питомий об’єм газової суміші і парціальний тиск її складових, якщо об'ємний склад суміші rСО2=(10+0,5N)%, rN2=(40+N)%, rН2О=100–(rСО2+r2)%, загальний тиск суміші Р =100+5N кПа, температура t=50оС.
