
- •Основы химической технологии
- •Раздел 1
- •1.1. Классификация химико-технологических процессов.
- •1.2. Основные технологические критерии эффективности
- •1.3. Технологические параметры хтп
- •1.3.1. Время пребывания исходных веществ в реакционной зоне.
- •Раздел 2
- •2.1. Каталитическое окисление аммиака
- •2.1.2. Введение
- •2.1.3. Теоретические основы процесса Химия процесса и равновесие.
- •Кинетика процесса.
- •2.1.4. Выбор оптимального технологического режима.
- •2.1.5. Схема лабораторной установки
- •2.1.6. Порядок проведения опыта
- •1. Подготовка колб для отбора газовых проб.
- •2. Техника проведения эксперимента.
- •Экспериментальные и расчетные данные
- •Контроль процесса
- •Анализ газовых фаз
- •Технологические расчеты
- •2.1.7. Задание
- •2.1.8. Техника безопасности
- •Материальный баланс контактного аппарата для окисления аммиака
- •Библиографический список
- •2.2. Электрохимическое получение гидроксида натрия, хлора и водорода диафрагменным методом
- •2.2.2. Введение
- •2.2.3. Теоретические основы процесса
- •Электродные реакции и термодинамика процесса электролиза водного раствора хлорида натрия в диафрагменной ванне.
- •Электродные реакции и потенциалы разряда ионов
- •Кинетика электродных процессов.
- •Выход по току
- •Удельный расход электроэнергии
- •Коэффициент использования электроэнергии
- •Конверсия сырья
- •2.2.4. Выбор оптимального технологического режима
- •Состав электролита
- •Материал электродов
- •Диафрагма
- •2.2.5. Экспериментальная часть
- •Исходные данные
- •Предварительные расчеты
- •Порядок выполнения работы
- •Экспериментальные данные
- •Контроль процесса Определение концентрации щелочи в католите.
- •1. В связи с техническими сложностями измерения объема подаваемого электролита и анализа всех продуктов при расчёте материального баланса делаем следующие допущения:
- •2. Последовательность расчета материального баланса
- •Материальный баланс процесса электролиза
- •Расчет технологических показателей
- •Технологические показатели процесса электролиза
- •2.2.6. Задание
- •2.2.5.Техника безопасности
- •Библиографический список
- •2.3. Контактное окисление оксида серы (IV).
- •2.3.2.Введение
- •2.3.3. Теоретические основы процесса
- •2.3.4. Выбор технологического режима.
- •Зависимость равновесного выхода η* от состава исходной газовой смеси
- •Зависимость равновесного выхода от температуры при различном давлении
- •2.3.5.Схема лабораторной установки
- •2.3.6.Предварительные расчеты
- •Значение давления водяных паров при t °с
- •2.3.7. Порядок проведения опыта.
- •Экспериментальные данные
- •Результаты проведения опыта
- •2.3.8. Расчет материального баланса.
- •2.3.9.Технологические расчеты
- •Показатели процесса окисления оксида серы (IV)
- •2.3.10. Задание
- •Приложение Определение степени превращения so2 в so3 (степени контактирования)
- •Библиографический список
- •Раздел 3
- •3.1. Получение метаналя (формальдегида) окислительным дегидрированием метанола
- •3.1.1. Цель работы
- •3.1.2. Введение
- •3.1.3. Теоретические основы процесса.
- •3.1.5. Описание лабораторной установки
- •3.1.6. Предварительные расчеты
- •3.1.7. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Технологические параметры и критерии процесса
- •Экспериментальные данные
- •3.1.8. Контроль процесса
- •3.1.9. Расчет материального баланса контактного аппарата.
- •Материальный баланс контактного аппарата для получения формальдегида.
- •3.1.10. Задание
- •3.2.3. Теоретические основы процесса
- •3.2.5. Описание лабораторной установки.
- •3.2.6. Порядок проведения опыта.
- •Исходные и экспериментальные данные
- •Объем спирта, поступившего в реактор……………………….…... Мл
- •Контроль процесса
- •Экспериментальные результаты опыта.
- •Данные хроматографического анализа контактного газа
- •3.2.7. Расчет материального баланса реактора
- •Материальный баланс реактора синтеза бутадиена.
- •3.2.8. Задание
- •3.3.3. Теоретические основы процесса
- •Механизм превращения углеводородов в процессе пиролиза
- •3.3.4. Выбор оптимального технологического режима
- •3.3.5. Описание лабораторной установки
- •3.3.6. Порядок проведения опыта
- •Исходные и экспериментальные данные
- •Экспериментальные данные проведения опыта
- •3.3.7. Расчет материального баланса пиролиза
- •3.3.8. Задание
- •Библиографический список.
- •Раздел 4
- •4.1. Хроматографический анализ
- •Характеристики хроматографических пиков
2.1.4. Выбор оптимального технологического режима.
Выбор оптимальных условий для сложного необратимого каталитического процесса сводится к созданию такого технологического режима, который обеспечивал бы высокую скорость основной реакции.

Рис.2.1.1. Схема окисления аммиака кислородом на поверхности
платинового катализатора: 1 – старые связи, 2 – вновь
образовавшиеся связи, 3 – место разрыва связей.

Рис.2.1.2. Зависимость количества адсорбированного газа от
температуры. 1 – равновесная кривая физической адсорбции, 2 и 3 – равновесная и практическая кривые хемосорбции
Это в первую очередь определяется правильным подбором катализатора и условий, обеспечивающих его высокую селективность и активность.
Температура. На платиновом катализаторе с изменением температуры практический выход оксида азота (II) изменяется по кривой с максимумом (рис.2.1.3). Такой характер кривой определяется влиянием температуры на возможность протекания побочных реакций и на их скорость.
При низких температурах, примерно до 500°С, когда количество адсорбированного кислорода сравнительно невелико, окисление аммиака протекает в основном с образованием элементарного азота (2.1.2), некоторого количества оксида азота (II) и, возможно, оксида азота (I).

Рис.2.1.3. Зависимость практического выхода оксида азота (II) от
температуры при разных давлениях : 1 – 0,1 МПа, 2 – 0,8 МПа
С повышением температуры до 700-800°С выход NO возрастает, так как увеличивается доля активных центров катализатора, занятых кислородом (кривая 3, рис.2.1.2) и растет скорость диффузии исходных веществ к поверхности катализатора. При дальнейшем повышении температуры происходит десорбция кислорода, и резко возрастают скорости побочных каталитических реакций и реакций, протекающих в объеме. В результате снижается выход оксида азота (II) и возрастает выход элементарного азота. При выборе температуры окисления аммиака необходимо учитывать другой фактор, влияющий на экономические показатели процесса - потери дорогостоящей платины, которые возрастают с повышением температуры.
Температура должна быть тем выше, чем больше примесей содержится в аммиачно-воздушной смеси. Необходимый температурный режим в реакторе может быть обеспечен теплом, выделяющимся при реакциях окисления аммиака.
Состав исходной смеси. Для обеспечения высокого выхода оксида азота (II) необходимо проводить процесс при избытке кислорода (рис 2.1.4). При стехиометрическом отношении кислорода к аммиаку (см. реакцию (2.1.1)), равном 1,25, часть активных центров катализатора не заполняется кислородом, что способствует реакциям разложения аммиака, окисления его до N2 и, возможно, до N2O. В промышленности объемное отношение поддерживается в пределах 1,7-1,9
Повышение отношения кислорода к аммиаку свыше двух незначительно сказывается на выходе оксида азота (II), но приводит к снижению концентрации оксида азота (II) в нитрозных газах за счет введения воздуха, что отрицательно сказывается на работе абсорбционного отделения. При использовании неплатиновых катализаторов отношение кислорода к аммиаку должно быть более двух.
Аммиачно-воздушные смеси способны взрываться, причем с повышением температуры газовой смеси границы взрываемости аммиачно-воздушных смесей расширяются и взрыв происходит при более низкой концентрации аммиака. Например, при температуре 250°С предел взрываемости аммиачно-воздушной смеси находится при содержании аммиака в смеси от 14 до 30% объем., а при температуре 450оС - от 12,3 до 33,9% объем. Практически применяемые аммиачно-воздушные смеси при концентрации в них аммиака 9.5-11,8% объем. не взрывоопасны.

Рис.2.1.4. Зависимость практического выхода оксида азота (II) от
объемного отношения кислорода к аммиаку
Давление. Давление в процессе окисления аммиака связано с температурой. Чем выше давление, тем требуется более высокая температура для достижения одного и того же выхода оксида азота (II) (рис.2.1.3). С повышением давления затрудняется процесс десорбции продуктов каталитического окисления с поверхности катализатора в объём. Для компенсации этого необходимо повышать температуру процесса. Рекомендуются следующие сочетания температуры и давления:
Давление процесса, МПа
|
0,1
|
0,304-0,51
|
0,71-1,011
|
Температура, °С
|
780-800
|
850-870
|
880-920
|
Проведение процесса окисления аммиака под давлением имеет ряд преимуществ: повышается скорость процесса, увеличивается интенсивность катализатора, значительно возрастает скорость последующих стадий в производстве азотной кислоты: реакции 2NO+O2=2N02 и абсорбции нитрозных газов водой.
Повышение давления имеет большое значение для работы агрегатов большой единичной мощности. Однако с повышением давления увеличиваются потери платины. Потери платины из-за летучести образующихся на ее поверхности оксидов и ее эрозии составляют при 900-950С и 0,8 МПа 250-400 мг на 1 т 100 % HNO3 . Часть платины осаждается на стенках коммуникаций и может быть собрана и регенерирована (до 50-70 % Pt). Потери платины могут быть уменьшены за счет добавок других металлов 8-ой группы (Pd, Rh, Ru).
Время
контактирования
(рис.2.1.5).
Реакция окисления аммиака происходит
во внешнедиффузионной области, и поэтому
увеличение объемной скорости оказывает
положительное влияние на интенсивность
процесса. С повышением, до определенного
предела, объемной скорости поток газовой
смеси становится более турбулентным,
что увеличивает скорость диффузии
исходных веществ к поверхности
катализатора. Наряду с этим уменьшается
время соприкосновения газовой смеси с
горячими стенками аппаратов, что снижает
возможность окисления аммиака до азота.
При дальнейшем росте объемной скорости
(уменьшении времени контактирования
![]() )
возможен проскок аммиака, который за
контактной зоной превращается в
элементарный азот при окислении
кислородом. Не исключена также возможность
образования азота при взаимодействии
аммиака с оксидом азота (II).
)
возможен проскок аммиака, который за
контактной зоной превращается в
элементарный азот при окислении
кислородом. Не исключена также возможность
образования азота при взаимодействии
аммиака с оксидом азота (II).
В заводских условиях в зависимости от качества катализатора и точности соблюдения заданного технологического режима достигается значительная селективность процесса, и выход оксида азота (II) составляет 92- 98%. При оптимальных условиях проведения процесса и правильном подборе конструкционных материалов побочные реакции (2.1.3), (2.1.5), (2.1.6) не имеют существенного значения.
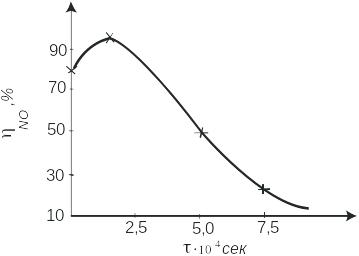
Рис.2.1.5. Зависимость практического выхода оксида азота(II) от
времени контактирования
