
- •Ответы к экзамену по Химии:
- •1)Основные химические законы и понятия.
- •2)Строение атомов. Модель атома по Резенфорду, по Бору.
- •3)Волновые свойства электрона. Принцип неопределённости Гейзенберга.
- •4)Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5)Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами.
- •6)Периодический закон д.И. Менделеева. Структура периодической системы.
- •7)Развитие периодического закона. Энергия ионизации, сродство к электрону, электроотрицательность.
- •8)Химическая связь и валентность.
- •9)Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10)Ионная связь. Типы ковалентных молекул.
- •11)Межмолекулярные взаимодействия, их типы, характеристика.
- •12)Донорно-акцепторная связь. Водородная связь.
- •13)Металлическая связь. Структура твёрдых тел.
- •14)Элементы химической термодинамики. Первое начало термодинамики.
- •15)Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствия из него.
- •16)Элементы второго начала термодинамики. Энтропия.
- •17)Энергия Гиббса. Направленность химических процессов.
- •18)Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19)Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20)Цепные реакции. Гомогенный катализ.
- •21)Скорость гетерогенных реакций. Гетерогенный катализ.
- •22)Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твёрдых тел, жидкостей в жидкостях.
- •23)Первые и второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа.
- •24)Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25)Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26)Диссоциация воды. Водородный показатель.
- •27)Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28)Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29)Теория гальванических элементов.
- •30)Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31)Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея.
- •32)Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33)Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34)Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35)Топливные элементы.
- •36)Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37)Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38)Методы защиты металлов от коррозии.
- •39)Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40)Получение металлов из руд. Способы получения металлов высокой чистоты.
- •41)Общие химический свойства металлов.
- •42)Лёгкие конструкционные материалы. Алюминий. Свойства, получение, применение в технике, важнейшие соединения.
- •43)Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44)Олово. Железо. Свойства, получение, применение, важнейшие соединения.
- •45)Высокомолекулярные соединения, их виды, способы получения вмс.
- •46)Получение высокомолекулярных веществ с помощью поликонденсации.
- •47)Применение полимеров. Основные полимеры, получаемые полимеризацией.
- •48)Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
15)Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствия из него.
Ответ: Внутренняя энергия и энтальпия: Всякое тело (система) – содержит в скрытом виде энергию – называемую – внутренней энергией U, она обусловлена различными формами движения частиц (молекул, атомов, электронов). И меж частичных взаимодействий. Однако кинетическая энергия тела в целом и потенциальная энергия его положения не являются внутренней энергией. Если какой либо системе сообщить из вне некоторое количество теплоты Q (например нагрев газа в цилиндре с поршнем), то Q будет расходоваться: а)на превращение внутренней энергии ( - то есть нагрев газа); б)на совершение работы А против внешних сил (подъём поршня): Превращение внутренней энергии какой-либо системы – равно количеству сообщаемой системе теплоты (Q) за вычетом работы (A) совершаемой системой: , где U2 – энергия в конечном состоянии; U1 – энергия в начальном состоянии. , где: V2 – конечный объём системы; V1 – начальный объём системы. а)изохорный процесс (V=соnst), тогда и формула (1) то есть при изохорной процессе вся сообщаемая системе теплота расходуется на превращение внутренней энергии (нагрев воды в закрытом сосуде). Б)изобарный процесс (p=const) из формулы (1) Qр=(U2-U1)+p(V2-V1), Qр=(U2+pV2)-(U1+pV1), обозначим: U2+pV2=H2, U1+pV1=H1. т.к. абсолютны значения H и U – измерить нельзя положительными их изменениями. Таким образом при изобарном процессе вся сообщаемая системе теплота расходуется на превращение её энтальпии ( ).
Термохимические
уравнения: Химические уравнения в
которых указывается количество выделенной
или поглощённой энергии, а также
агрегатное состояние реагирующих
веществ называется – термохимическими.
А(г) – газообразное, А(п) – парообразное,
А(ж) – жидкое, А(т) – твёрдое.
СH4(г)+4HF(г)=СF4(г)+4H2(г);
![]() =-1916
кДж. Величина -1916 кДж – является тепловым
эффектом реакции (ТЭР). ТЭР – это
количество теплоты выделенное или
поглощённое в процессе реакции и
характеризующееся изменение энтальпии
(
).
Для сопоставления ТЭР-ов все термохимические
расчёты приводят к стандартных условия
:
а)к 1 молю конечного продукта (поэтому
возможен дробный коэффициент), б)к t=25
OC
(298 К); в)к р=1 ат (760 мм. рт.с; 101,3 кПа). Единицы
измерения ТЭР’ов: а)внесистемнные
калория (Ккал); б)в СИ: Дж (кДж); 1 кал=4,18
Дж. А(г)+В(г)=С(г);
=10
Дж – эндотермич. С(г)+Д(г)=Ст(г);
=-10
Дж –экзотермич. Энтальпия (теплота
образования)
=-1916
кДж. Величина -1916 кДж – является тепловым
эффектом реакции (ТЭР). ТЭР – это
количество теплоты выделенное или
поглощённое в процессе реакции и
характеризующееся изменение энтальпии
(
).
Для сопоставления ТЭР-ов все термохимические
расчёты приводят к стандартных условия
:
а)к 1 молю конечного продукта (поэтому
возможен дробный коэффициент), б)к t=25
OC
(298 К); в)к р=1 ат (760 мм. рт.с; 101,3 кПа). Единицы
измерения ТЭР’ов: а)внесистемнные
калория (Ккал); б)в СИ: Дж (кДж); 1 кал=4,18
Дж. А(г)+В(г)=С(г);
=10
Дж – эндотермич. С(г)+Д(г)=Ст(г);
=-10
Дж –экзотермич. Энтальпия (теплота
образования)
![]() - это количество теплоты необходимое
для образования одного моля сложного
вещества из простых веществ (тепло для
образования простых веществ примем
равным 0).
- это количество теплоты необходимое
для образования одного моля сложного
вещества из простых веществ (тепло для
образования простых веществ примем
равным 0).![]() 298
и
298
и
![]() - стандартная теплота образования ->
измерено для большинства веществ её
значения сведены в специальную таблицу.
Энтальпия (теплота разложений) – это
количество теплоты, необходимой для
разложения 1 моля сложного вещества на
простое.
- стандартная теплота образования ->
измерено для большинства веществ её
значения сведены в специальную таблицу.
Энтальпия (теплота разложений) – это
количество теплоты, необходимой для
разложения 1 моля сложного вещества на
простое.
Закон
Гесса и следствия из него: Тепловой
эффект в реакции не зависит от способа
её проведения, а зависит лишь от начального
и конечного состояния реагирующих
веществ (P и U=const).
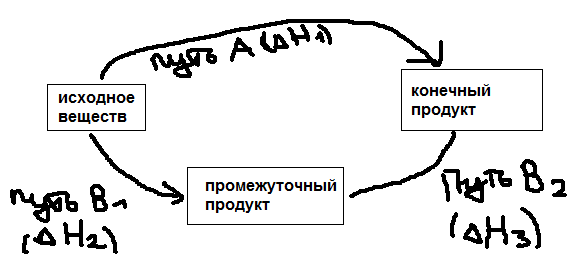 Всегда:
Всегда:
![]() то есть тепловой эффект процесса равен
сумме тепловых эффектов промежуточных
стадий. Следствия: 1)Тепло до образования
и разложения химического соединения –
одинаковы по абсолютным величинам но
противоположны по знаку:
то есть тепловой эффект процесса равен
сумме тепловых эффектов промежуточных
стадий. Следствия: 1)Тепло до образования
и разложения химического соединения –
одинаковы по абсолютным величинам но
противоположны по знаку:
![]() 2)Общие тепловой эффект реакции равен
разности между суммами тепла до
образования конечных продуктов и тепла
до образования исходного вещества с
учётом коэффициентов уравнений реакции:
2)Общие тепловой эффект реакции равен
разности между суммами тепла до
образования конечных продуктов и тепла
до образования исходного вещества с
учётом коэффициентов уравнений реакции:
![]() , где: ni,
mi –
коэффициент внутренних реакций;
, где: ni,
mi –
коэффициент внутренних реакций;
![]() -
в справочнике; Пример: Определите
метилового спирта по реакции его горения.
Химическое уравнение: 2CH3OH+3O2=2CO3+4H2O,
термохимическое уравнение: CH3OH+1
½ O2(г)=СO2(г)+2H2O(ж),
=-720,4
кДж (экзотермическое, т.к. “-“
).
Дано:
СO2=-398
кДж/моль;
H2O=-285,8
кДж/моль. Найти
CH3OH-?
Решение: из формулы (9): -
-
в справочнике; Пример: Определите
метилового спирта по реакции его горения.
Химическое уравнение: 2CH3OH+3O2=2CO3+4H2O,
термохимическое уравнение: CH3OH+1
½ O2(г)=СO2(г)+2H2O(ж),
=-720,4
кДж (экзотермическое, т.к. “-“
).
Дано:
СO2=-398
кДж/моль;
H2O=-285,8
кДж/моль. Найти
CH3OH-?
Решение: из формулы (9): -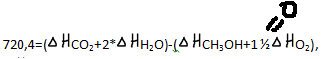 -720,4=(398+2*(-285,8))-(
CH3OH).
CH3OH=-248
кДж. 3)следствие: Сумма тепловых эффектов
для ряда последней реакции приводит
систему к начальному состоянию, равны
0.
-720,4=(398+2*(-285,8))-(
CH3OH).
CH3OH=-248
кДж. 3)следствие: Сумма тепловых эффектов
для ряда последней реакции приводит
систему к начальному состоянию, равны
0.

