
- •Ответы к экзамену по Химии:
- •1)Основные химические законы и понятия.
- •2)Строение атомов. Модель атома по Резенфорду, по Бору.
- •3)Волновые свойства электрона. Принцип неопределённости Гейзенберга.
- •4)Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5)Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами.
- •6)Периодический закон д.И. Менделеева. Структура периодической системы.
- •7)Развитие периодического закона. Энергия ионизации, сродство к электрону, электроотрицательность.
- •8)Химическая связь и валентность.
- •9)Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10)Ионная связь. Типы ковалентных молекул.
- •11)Межмолекулярные взаимодействия, их типы, характеристика.
- •12)Донорно-акцепторная связь. Водородная связь.
- •13)Металлическая связь. Структура твёрдых тел.
- •14)Элементы химической термодинамики. Первое начало термодинамики.
- •15)Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствия из него.
- •16)Элементы второго начала термодинамики. Энтропия.
- •17)Энергия Гиббса. Направленность химических процессов.
- •18)Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19)Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20)Цепные реакции. Гомогенный катализ.
- •21)Скорость гетерогенных реакций. Гетерогенный катализ.
- •22)Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твёрдых тел, жидкостей в жидкостях.
- •23)Первые и второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа.
- •24)Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25)Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26)Диссоциация воды. Водородный показатель.
- •27)Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28)Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29)Теория гальванических элементов.
- •30)Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31)Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея.
- •32)Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33)Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34)Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35)Топливные элементы.
- •36)Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37)Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38)Методы защиты металлов от коррозии.
- •39)Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40)Получение металлов из руд. Способы получения металлов высокой чистоты.
- •41)Общие химический свойства металлов.
- •42)Лёгкие конструкционные материалы. Алюминий. Свойства, получение, применение в технике, важнейшие соединения.
- •43)Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44)Олово. Железо. Свойства, получение, применение, важнейшие соединения.
- •45)Высокомолекулярные соединения, их виды, способы получения вмс.
- •46)Получение высокомолекулярных веществ с помощью поликонденсации.
- •47)Применение полимеров. Основные полимеры, получаемые полимеризацией.
- •48)Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
11)Межмолекулярные взаимодействия, их типы, характеристика.
Ответ:
Межмолекулярное взаимодействие
(ММВ) – Ван-дер-Ваальсова связь. В
зависимости от внешних условий вещества
могут находиться в: жидком, твёрдом и
газообразном состоянии (четвёртое
состояние – плазма – появляется при
Т=![]() 5000
CO в
результате термического разложения
молекул). Одно агрегатное состояние
вещества отличается от другого
характеристикой взаимодействия молекул
друг с другом природой притяжения
молекул во всех агрегатных состояниях.
Типы сил взаимодействия: 1)Ориентационная
– существует между полярными молекулами
(притяжение типа постоянный диполь).
5000
CO в
результате термического разложения
молекул). Одно агрегатное состояние
вещества отличается от другого
характеристикой взаимодействия молекул
друг с другом природой притяжения
молекул во всех агрегатных состояниях.
Типы сил взаимодействия: 1)Ориентационная
– существует между полярными молекулами
(притяжение типа постоянный диполь).
 2)Индукционное (деформационное) – между
полярными и неполярными молекулами,
притяжение типа постоянный диполь –
индуцированный диполь.
2)Индукционное (деформационное) – между
полярными и неполярными молекулами,
притяжение типа постоянный диполь –
индуцированный диполь.
 3)Дисперсионное взаимодействие – между
неполяризованными молекулами (притяжение
типа мгновенный диполь – индуцированный
диполь).
3)Дисперсионное взаимодействие – между
неполяризованными молекулами (притяжение
типа мгновенный диполь – индуцированный
диполь).
![]() При вращательном движении электрона и
комбинировании движения ядер в некотором
атоме происходим временное смещение
некоторых электронных орбит ядра, то
есть временное возникновение диполей,
эти мгновенные диполи взаимодействуют
друг с другом (жидкий аргон). 4)По
прочности: Eор>Eинд>Eдисп.
Eсв(ммв)=8-47 кДж/моль.
Eсв(кс)=125-420 кДж/моль.
При вращательном движении электрона и
комбинировании движения ядер в некотором
атоме происходим временное смещение
некоторых электронных орбит ядра, то
есть временное возникновение диполей,
эти мгновенные диполи взаимодействуют
друг с другом (жидкий аргон). 4)По
прочности: Eор>Eинд>Eдисп.
Eсв(ммв)=8-47 кДж/моль.
Eсв(кс)=125-420 кДж/моль.
12)Донорно-акцепторная связь. Водородная связь.
Ответ:
ДА-связь (Донорно-акцепторная
связь).
 ДА-связь возникает между атомами А и В
в том случае если атом В имеет – свободную
не поделенную пару электронов, которую
он отдаёт в общее пользование атому А,
имеющего свободную орбиталь.
ДА-связь возникает между атомами А и В
в том случае если атом В имеет – свободную
не поделенную пару электронов, которую
он отдаёт в общее пользование атому А,
имеющего свободную орбиталь.
![]() Пример:
Пример:
 Соединения в которых действует одна
или несколько ДА-связей – называются
комплексными.
Соединения в которых действует одна
или несколько ДА-связей – называются
комплексными.
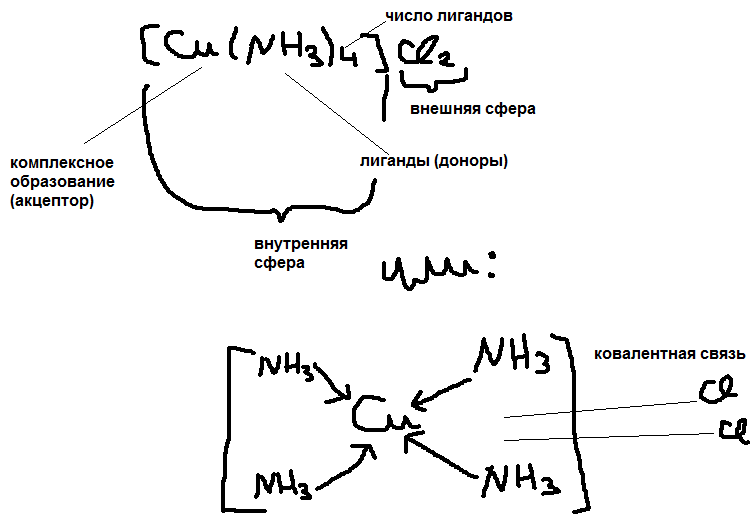 Комплексное образование (акцепторные
элементы) могут быть: а)ионы d-металлов
Ag+ Сu+2
Pt+4; б)нейтральные
d-металлы Fe;
Mn; Mo; в)атомы
неметаллов с положительностью степенью
окисления: B+3, P+5.
Лигандами (донорами) – могут быть:
а)отрицательно заряженные ионы: OH-,
Cl-, Br-,
CN-, S2-,
SO42-, NO2-
и другие кислотные остатки. б)нейтральные
полярные молекулы: H2O,
NH3, PH3,
CO, NO. Число
показывающее сколько лигандов
присоединяется к комплексному образованию
– называет координационным числом
последнего КЧ=1-12 (чаще 4 и 6). Пример:
Записана формула комплексного соединения
состава: PtCl4*2NH3*3H2O
(КЧ=6) [Pt(NH3)2(H2O)3Cl]Cl3
Молекула комплексного соединения
(иона) в целом электро нейтральна, то
есть заряд внешней сферы равен заряду
внутренней сферы с обратным знаком.
Заряд внутри сферы (w)
равен сумме заряда комплекса
образовательного и легенды: w=Zk+ZN
Комплексное образование (акцепторные
элементы) могут быть: а)ионы d-металлов
Ag+ Сu+2
Pt+4; б)нейтральные
d-металлы Fe;
Mn; Mo; в)атомы
неметаллов с положительностью степенью
окисления: B+3, P+5.
Лигандами (донорами) – могут быть:
а)отрицательно заряженные ионы: OH-,
Cl-, Br-,
CN-, S2-,
SO42-, NO2-
и другие кислотные остатки. б)нейтральные
полярные молекулы: H2O,
NH3, PH3,
CO, NO. Число
показывающее сколько лигандов
присоединяется к комплексному образованию
– называет координационным числом
последнего КЧ=1-12 (чаще 4 и 6). Пример:
Записана формула комплексного соединения
состава: PtCl4*2NH3*3H2O
(КЧ=6) [Pt(NH3)2(H2O)3Cl]Cl3
Молекула комплексного соединения
(иона) в целом электро нейтральна, то
есть заряд внешней сферы равен заряду
внутренней сферы с обратным знаком.
Заряд внутри сферы (w)
равен сумме заряда комплекса
образовательного и легенды: w=Zk+ZN
![]() Пример №1:
Пример №1:
 Пример2:
Пример2:
 Комплексное соединение будучи сильными
электролитами легко диссоциируется в
водных растворах но внутреннюю сферу
комплексного ион и внешнюю сферу:
Комплексное соединение будучи сильными
электролитами легко диссоциируется в
водных растворах но внутреннюю сферу
комплексного ион и внешнюю сферу:
![]() Внутренняя же сфера (комплексный ион)
очень значительно диссоциируется на
комплекс образовательный и легенды то
есть является слабым электролитом.
Внутренняя же сфера (комплексный ион)
очень значительно диссоциируется на
комплекс образовательный и легенды то
есть является слабым электролитом.
![]() Устойчивость комплексного иона
характеризует К (нестойкости):
Устойчивость комплексного иона
характеризует К (нестойкости):
![]() или
больше Кнест. Тем меньше прочности
комплексного иона.
или
больше Кнест. Тем меньше прочности
комплексного иона.
Дативная
вязь – это такая связь, когда одна
частица является одновременно и донором
и акцептором электрона.
 Водородная связь: Давно было замечено
что соединения в которых атом водорода
непосредственно связан с: N,
O, F (Сl)
– обладает рядом аномальным свойств.
Это проявляется в температуре плавления,
температуре кипения подобных соединений.
Например соединение водорода с элементами
6 группы. Известно, что среди однотипных
соединений одной подгруппы температура
плавления, температура кипения – зависят
от молярной массы соединения, чем она
больше тем больше температура плавления
и температура кипения.
Водородная связь: Давно было замечено
что соединения в которых атом водорода
непосредственно связан с: N,
O, F (Сl)
– обладает рядом аномальным свойств.
Это проявляется в температуре плавления,
температуре кипения подобных соединений.
Например соединение водорода с элементами
6 группы. Известно, что среди однотипных
соединений одной подгруппы температура
плавления, температура кипения – зависят
от молярной массы соединения, чем она
больше тем больше температура плавления
и температура кипения.
 Эти и другие особенности подобных
соединений объясняются способностью
атома водорода (H)
соединённого с атомом сильно
электроотрицательного элемента, к
образованию ещё одной химической связи
с другим подобным атомом другой молекулы
– такая связь называется – водородной
связью (HF).
Эти и другие особенности подобных
соединений объясняются способностью
атома водорода (H)
соединённого с атомом сильно
электроотрицательного элемента, к
образованию ещё одной химической связи
с другим подобным атомом другой молекулы
– такая связь называется – водородной
связью (HF).
 При взаимодействии H+F
атом F оттягивает на себя
электронное облаком с атомом водорода
(H), приобретая при этом
дополнительный отрицательный заряд. А
ядро атома водорода с внешней стороны
лишается электронного облака (оголяется).
Теперь этот протон электрически
взаимодействует с электронной оболочкой
соседней молекулы HF, и
внедряется в её, образуя водородную
связь. Такая связь характеризуется
только для атомов H, т.к.
все другие атомы имеют внутренние
электрические слои, играющие экранирующую
роль. Водородная связь менее прочна,
чем ковалентная связь. Eкс=125-420
кДж/моль; Eвс=15-40 кДж/моль.
Однако этой энергии недостаточно, чтобы
вызвать ассоциацию молекулы, то есть
их объединение, в димеры, тримеры,
тетромеры… Именно ассоциация молекулы
затрудняющая их отрыв друг от друга и
служит причиной аномально высокой
Tплавления и Tкипения
таких соединений как: HF,
H2O,
NH3. Водородная связь
как менее прочна чем ковалентная связь
обозначается точками:
При взаимодействии H+F
атом F оттягивает на себя
электронное облаком с атомом водорода
(H), приобретая при этом
дополнительный отрицательный заряд. А
ядро атома водорода с внешней стороны
лишается электронного облака (оголяется).
Теперь этот протон электрически
взаимодействует с электронной оболочкой
соседней молекулы HF, и
внедряется в её, образуя водородную
связь. Такая связь характеризуется
только для атомов H, т.к.
все другие атомы имеют внутренние
электрические слои, играющие экранирующую
роль. Водородная связь менее прочна,
чем ковалентная связь. Eкс=125-420
кДж/моль; Eвс=15-40 кДж/моль.
Однако этой энергии недостаточно, чтобы
вызвать ассоциацию молекулы, то есть
их объединение, в димеры, тримеры,
тетромеры… Именно ассоциация молекулы
затрудняющая их отрыв друг от друга и
служит причиной аномально высокой
Tплавления и Tкипения
таких соединений как: HF,
H2O,
NH3. Водородная связь
как менее прочна чем ковалентная связь
обозначается точками:

